首页> 卫生资格考试> 初级药士/药师/主管药师> 初级药师> 考试辅导> 文章内容
2019年初级药师考试相关专业知识考点:靶向制剂
来源 :中华考试网 2018-09-09
中靶向制剂
(一)靶向制剂的概念
靶向制剂又称靶向给药系统,是指载体将药物通过局部给药或全身血液循环而选择性地浓集定位于靶组织、靶器官、靶细胞或细胞内结构的给药系统。靶向制剂还可以解决药物在其他制剂给药时可能遇到的以下问题:
①药剂学方面的稳定性低或溶解度小;
②生物药剂学方面的吸收小或生物不稳定性(酶、pH等);
③药物动力学方面的半衰期短和分布面广而缺乏特异性;
④临床方面的治疗指数(中毒剂量和治疗剂量之比)低和解剖屏障或细胞屏障等。
靶向制剂设计的目的是希望通过选择性传递药物至靶区(即药理受体),以最小剂量最大限度的提高疗效,降低毒副作用。
1.靶向性评价 药物制剂的靶向性可由相对摄取率(γe)、靶向效率(te)和峰浓度比(Ce)三个参数来衡量。
(1)相对摄取率(γe)
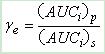
式中AUCi为由浓度-时间曲线求得的第i个器官或组织药-时曲线下面积,脚标p和s分别表示药物制剂及药物溶液。凡γe>1表示药物制剂在该器官或组织有靶向性,γe愈大靶向效果愈好;γe≤1表示无靶向性。
(2)靶向效率(te)
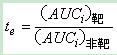
式中,te为表示药物制剂或药物溶液对靶器官的选择性。te值>1表示药物制剂对靶器官比某非靶器官有选择性;te值愈大,选择性愈强;药物制剂的te值与药物溶液的te值相比,说明药物制剂靶向性增强的倍数。
(3)峰浓度比(Ce)
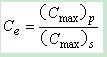
式中, Cmax为峰浓度,每个组织或器官中的Ce值表明药物制剂改变药物分布的效果,Ce值愈大,表明改变药物分布的效果愈明显。
2.靶向制剂的分类
靶向制剂分类方法有多种。按给药途径分为注射用靶向制剂和非注射用靶向制剂(如局部用药)两大类;按分布水平可分为一级(器官)靶向、二级(组织)靶向、三级(细胞)靶向和四级(亚细胞、分子)靶向;按载体材料组成、粒子大小、形态特征和靶向原理分为微球(囊)、纳米球(囊、粒)、脂质体、乳剂、复乳、大分子药物载体、前体药物等;按靶向制剂所具有的功能可分为单功能靶向制剂、双功能靶向制剂和多功能靶向制剂;按靶向性原动力可分为被动靶向、主动靶向(免疫载体、前体药物等)和物理化学靶向(磁性、栓塞)等。
3.靶向制剂的质量要求
对于注射用靶向制剂,根据注射剂的特殊性,应从多方面进行考虑,包括材料、药品和制备方法等。应根据不同适用目的选择不同的材料;选择药物时,应考虑药物的剂量不能太大;制备方法不同,载体中的载药量。粒度、有机溶剂的残留量等不同。另外,还应考虑载体材料对药物的包埋能力,药物与材料的相互作用,工艺过程中可能产生有毒物质等。
总之,对于注射用靶向制剂而言,其质量首先应符合一般注射剂的质量要求,如无毒、无热原、无过敏性物质、无降解物质等;其次,载体中药物的突释效应应低,载体应具备定位蓄积、控制释放和无毒性可生物降解等三项基本要求。除此之外,根据不同的给药方式,对粒径的要求亦不同,如肺部靶向载体的粒径应大些。
(二)被动靶向制剂
被动靶向制剂即自然靶向制剂。系利用药物载体,使药物被生理过程自然吞噬而实现靶向的制剂。脂质体、微球与微囊和纳米粒、纳米球与纳米囊、乳剂等都可以作为被动靶向制剂的载体。
1.脂质体
脂质体是将药物包封于类脂质双分子层形成的薄膜中间所得的超微型球状载体。脂质体根据其结构和所包含的双层磷脂膜层数,可分为单室脂质体和多室脂体。凡由一层类脂质双分子层构成者,称为单室脂质体,它又分大单室脂质体(LUVs,粒径在0.1~1μm之间)和小单室脂质体(SUVs,粒径0.02~0.08μm,可称为纳米脂质体)。
由多层类脂质双分子层构成的称为多室脂质体(MLVs),粒径在1~5μm之间。单室脂质体中水溶性药物的溶液只被一层类脂质双分子层所包封,脂溶性药物则分散于双分子层中。多室脂质体中有几层脂膜滤后也可得到SUVs。
(1)脂质体的组成与结构:脂质体的结构与由表面活性剂构成的胶束不同,后者是由单分子层所组成,而脂质体由双分子层所组成。脂质体的组成成分是磷脂及附加剂。
胆固醇亦属于两亲物质,其结构中亦具有疏水与亲水两种基团,但疏水性较亲水性强。用磷脂与胆固醇作脂质体的膜材时,必须先将两者溶于有机溶剂,然后蒸发除去有机溶剂,在器壁上形成均匀的类脂质薄膜,此薄膜是由磷脂与胆固醇混合分子相互间隔定向排列的双分子层所组成。
(2)脂质体的理化性质:①相变温度:脂质体的物理性质与介质温度有密切关系。当温度升高时,脂质体双分子层中酰基侧键可从有序排列变为无序排列,从而引起一系列变化,如由“胶晶”变为液晶态,膜的横切面增加、厚度减少、流动性增加等。转变时的温度称为相变温度,相变温度的高低取决于磷脂的种类。
②电性:含磷脂酸(PA)和磷脂酰丝氨酸(PS)等的酸性脂质体荷负电,含碱基(胺基)如十八胺等的脂质体荷正电,不含离子的脂质体显电中性。脂质体表面的电性对其包封率、稳定性、靶器官分布及对靶细胞的作用均有影响。
(3)脂质体的特点:①靶向性:载药脂质体进人体内可被巨噬细胞作为外界异物而吞噬,脂质体以静脉给药时,能选择地集中于网状内皮系统,70%~89%集中于肝、脾;②缓释性:将药物包封于脂质体中,可减少肾排泄和代谢而延长药物在血液中的滞留时间,使某些药物在体内缓慢释放,延长药物的作用时间;
③降低药物毒性:药物被脂质体包封后,主要被网状内皮系统的巨噬细胞所吞噬,在肝、脾和骨髓等网状内皮细胞较丰富的器官中集中,而使药物在心、肾中累积量比游离型药物明显降低。因此如将对心、肾有毒性的药物或对正常细胞有毒性的抗癌药包封于脂质体中,可明显降低药物的毒性;④提高药物稳定性:不稳定的药物被脂质体包封后受到脂质体双层膜的保护,可提高稳定性。
(4)制备脂质体的材料: 脂质体的膜材主要由磷脂与胆固醇构成,这两种成分是形成脂质体双分子层的基础物质,由它们所形成的“人工生物膜”易被机体消化分解。磷脂类包括卵磷脂、脑磷脂、大豆磷脂以及其他合成磷脂,胆固醇与磷脂是共同构成细胞膜和脂质体的基础物质。胆固醇具有调节膜流动性的作用,故可称为脂质体“流动性缓冲剂”。当低于相变温度时,胆固醇可使膜减少有序排列,而增加流动性;高于相变温度时,可增加膜的有序排列而减少膜的流动性。
(5)脂质体在体内的作用机制: 脂质体属于胶体系统,其组成与细胞膜相似,能显著增强细胞摄取,延缓和克服耐药性,脂质体在体内细胞水平上的作用机制有吸附、脂交换、内吞、融合等。
①吸附是脂质体作用的开始,为普通物理吸附,受粒子大小、密度和表面电荷等因素影响,如脂粒与细胞表面电荷相反,吸附作用大。
②脂质体的脂类与细胞膜上的脂类发生交换称为脂交换。其交换过程包括:脂质体先被细胞吸附,然后在细胞表面蛋白的介导下,特异性交换脂类的极性基团或非特异性地交换酰基链。交换仅发生在脂质体双分子层中外部单分子层和细胞质膜外部的单分子层之间,而脂质体内药物并未进入细胞。脂质体可与血浆中各种组织细胞相互作用进行脂交换。
③内吞作用是脂质体的主要作用机制。脂质体被单核巨噬细胞系统,特别是巨噬细胞作为外来异物吞噬,称内吞作用。通过内吞,脂质体能特异地将药物浓集于起作用的细胞房室内,也可使不能通过浆膜的药物达到溶酶体内。融合指脂质体的膜材与细胞膜的构成物相似而融合进入细胞内,然后经溶酶体消化释放药物。
(6)脂质体的制备与质量评价: 脂质体的制备方法很多,常用的有:①注入法;②薄膜分散法;③超声波分散法;④逆相蒸发法;⑤冷冻干燥法。
其质量评价方法包括:形态、粒径及其分布;包封率和载药量;渗漏率;药物体内分布。
影响脂质体中药物包封率的因素主要包括:类脂质膜材料的投料比;脂质体的电荷;脂质体粒径大小;药物的溶解度和制备容器等。
2.微囊与微球
微型包囊是近40年来应用于药物的新工艺、新技术,其制备过程通称微型包囊术,简称微囊化。利用天然的或合成的高分子材料(统称为囊材)作为囊膜,将固态药物或液态药物(统称为囊心物)包裹而成药库型微型胶囊,简称微囊。使药物溶解和(或)分散在高分子材料基质中,形成骨架型(亦称基质型)微小球状实体,称微球。作为靶向制剂的微囊与微球的粒径范围为1~250μm。有的文献未加以严格区分,将微囊或微球统称为微粒。
药物微囊化的目的:①掩盖药物的不良气味及口味;②提高药物的稳定性;③防止药物在胃内失活或减少对胃的刺激;④使液态药物固态化便于应用与储存;⑤减少复方药物的配伍变化;⑥可制备缓释或控释制剂;⑦使药物浓集于靶区,提高疗效,降低毒副作用;⑧可将活细胞或生物活性物质包囊。
(1)囊心物:微囊的囊心物除主药外还可以包括提高微囊化质量而加入的附加剂,如稳定剂、稀释剂、控制释放速率的阻滞剂、促进剂以及改善囊膜可塑性的增塑剂等。囊心物可以是固体,也可以是液体。通常将主药与附加剂混匀后微囊化;亦可先将主药单独微囊化,再加入附加剂。若有多种主药,可将其混匀再微囊化,亦可分别微囊化后再混合。
(2)囊材: 用于包囊所需的材料称为囊材。对囊材的一般要求是:①性质稳定;②有适宜的释放速率;③无毒、无刺激性;④能与药物配伍,不影响药物的药理作用及含量测定;⑤有一定的强度及可塑性,能完全包封囊心物;⑥具有符合要求的黏度、穿透性、亲水性、溶解性、降解性等特性。常用的囊材分下述三大类:
1)天然高分子囊材:天然高分子材料是最常用的囊材,因其稳定、无毒、成膜性好。常用的有:明胶、阿拉伯胶、海藻酸盐、壳聚糖等。
2)半合成高分子囊材:做囊材的半合成高分子材料多系纤维素衍生物,其特点是毒性小、黏度大、成盐后溶解度增大。常用的有:羧甲基纤维素盐、醋酸纤维素酞酸酯(CAP)、乙基纤维素(EC)、甲基纤维素(MC)、羟丙甲纤维素(HPMC)等。
3)合成高分子囊材:做囊材用的合成高分子材料有生物不降解的和生物可降解的两类。生物不降解,且不受pH影响的囊材有聚酰胺、硅橡胶等。生物不降解,但在一定pH条件下可溶解的囊材有聚丙烯酸树脂、聚乙烯醇等。近年来,生物可降解的材料得到了广泛的应用,如聚碳酯、聚氨基酸、聚乳酸(PLA)、丙交酯-乙交酯共聚物(PLGA)、聚乳酸-聚乙二醇嵌段共聚物(PLA-PEG)、ε-己内酯与丙交酯嵌段共聚物等,其特点是无毒、成膜性好、化学稳定性高,可用于注射。
(3)微囊的制备
1)物理化学法: 本法在液相中进行,囊心物与囊材在一定条件下形成新相析出,故又称相分离法。其微囊化步骤大体可分为囊心物的分散、囊材的加入、囊材的沉积和囊材的固化四步。相分离法分为单凝聚法、复凝聚法、溶剂-非溶剂法、改变温度法和液中干燥法。
① 单凝聚法: 是在高分子囊材溶液中加入凝聚剂以降低高分子材料的溶解度而凝聚成囊的方法,是相分离法中较常用的一种方法。基本原理是:如将药物分散在明胶材料溶液中,然后加入凝聚剂(可以是强亲水性电解质硫酸钠水溶液,或强亲水性的非电解质如乙醇),由于明胶分子水合膜的水分子与凝聚剂结合,使明胶的溶解度降低,分子间形成氢键,最后从溶液中析出而凝聚形成凝聚囊。
这种凝聚是可逆的,一旦解除凝聚的条件(如加水稀释),就可发生解凝聚,凝聚囊很快消失。这种可逆性在制备过程中可加以利用,经过几次凝聚与解凝聚,直到凝聚囊形成满意的形状为止(可用显微镜观察)。最后再采取措施加以交联,使之成为不凝结、不粘连、不可逆的球形微囊。
单凝聚法的成囊条件:凝聚系统的组成;明胶溶液的浓度与温度;药物及凝聚相的性质;凝聚囊的流动性及其与水相间的界面张力;交联固化。常用甲醛作交联剂,通过胺醛缩合反应使明胶分子互相交联而固化。
影响单凝聚法成囊的因素:凝聚剂的种类和pH;药物的性质;增塑剂的影响。
② 复凝聚法: 系使用带相反电荷的两种高分子材料作为复合囊材,在一定条件下交联且与囊心物凝聚成囊的方法。复凝聚法是经典的微囊化方法,适合于难溶性药物的微囊化。
可作复合材料的有明胶与阿拉伯胶(或CMC、CAP等多糖)、海藻酸盐与聚赖氨酸、海藻酸盐与壳聚糖、海藻酸与清蛋白、清蛋白与阿拉伯胶等。
现以明胶与阿拉伯胶为例,说明复凝聚法的基本原理。将溶液pH调至明胶的等电点以下使之带正电(pH4.0~4.5时明胶带的正电荷多),而阿拉伯胶仍带负电,由于电荷互相吸引交联形成正、负离子的络合物,溶解度降低而凝聚成囊,加水稀释,加入甲醛交联固化,洗去甲醛,即得。
③ 溶剂-非溶剂法: 是在囊材溶液中加入一种对囊材不溶的溶剂(非溶剂),引起相分离,而将药物包裹成囊的方法。
2)物理机械法: 本法是将固态或液态药物在气相中进行微囊化的方法,需要一定设备条件。包括:喷雾干燥法、喷雾凝结法、空气悬浮法、多孔离心法、锅包衣法。
3)化学法: 包括界面缩聚法、辐射交联法。
(4)微球的制备:微球系药物与高分子材料制成的基质骨架的球形或类球形实体。药物溶解或分散于实体中,其大小因使用目的而异,通常微球的粒径范围为1~250μm。微球的制备方法与微囊的制备有相似之处。根据材料和药物的性质不同可以采用不同的微球制备方法。
如明胶微球,采用明胶等天然高分子材料,以乳化交联法制备微球;清蛋白微球可用上述的液中干燥法或喷雾干燥法制备;淀粉微球系由淀粉水解再经乳化聚合制得;聚酯类微球可用液中干燥法制备;磁性微球,首先用共沉淀反应制备磁流体,再制备含药磁性微球,最后在无菌操作条件下静态吸附药物,制得含药磁性微球。
(5)影响粒径的因素:囊心物的大小、囊材的用量、制备方法、制备温度、制备时的搅拌速率、附加剂的浓度和囊材相的黏度。
(6)微囊与微球中药物的释放及体内转运:通常有以下3种释药机制: ① 扩散: 药物在不溶性囊壁中扩散,是物理过程。即微囊进入体内后,体液向微囊中渗入而逐渐溶解微囊中的药物并将药物扩散出囊壁。② 囊壁的溶解: 囊壁溶解属于物理化学过程,但不包括酶的作用。其速率主要取决于囊材的性质、体液的体积、组成、pH以及温度等。另外,囊壁还可能由于压力、剪切力、磨损等而破裂,引起药物的释放。③ 囊壁的消化与降解: 这是在酶作用下的生化过程。当微囊进入体内后,囊壁可受胃蛋白酶或其他酶的消化与降解成为体内的代谢产物,同时使药物释放出来。
影响药物释放速率的因素有: ①微囊与微球的粒径:在载体材料一定的条件下,粒径愈小界面积愈大,释放速率也应愈高。例如,磺胺嘧啶微囊,其释放速率随粒径减小而增高。②微囊囊壁的厚度:囊壁材料相同时,囊壁愈厚释药愈慢;即囊心物与囊壁的重量比愈小,释药愈慢。主要是因为囊壁厚时药物的释放路径延长的缘故。③载体材料的物理化学性质:常用的几种囊材形成的囊壁释放速率的次序如下:明胶>乙基纤维素>苯乙烯-马来酸酐共聚物>聚酰胺。④药物的性质:在载体材料相同时,溶解度大的药物释放较快。⑤工艺条件与剂型:工艺条件对释放速率有明显影响。⑥介质的pH:在不同pH条件下微囊的释放速率也不同。⑦介质的离子强度:在相同介质中,离子强度不同释药速率也不同。
(7)微囊、微球的质量评价: 目前微囊、微球的质量评价,除制成的制剂本身要求应符合药典规定外,还包括形态、粒径及其分布;药物的含量;药物的载药量与包封率;药物的释放速率;有机溶剂残留量。
(三)主动靶向制剂
主动靶向制剂是用修饰的药物载体作为“导弹”,将药物定向地运送到靶区浓集发挥药效。主动靶向制剂包括经过修饰的药物载体和前体药物与药物大分子复合物两大类制剂。修饰的药物载体有修饰脂质体、修饰微乳、修饰微球、修饰纳米球、免疫纳米球等;前体药物包括抗癌药及其他前体药物、脑部位和结肠部位的前体药物等。
1.修饰的药物载体
药物载体经修饰后可将疏水表面由亲水表面代替,就可以减少或避免单核巨噬细胞系统的吞噬作用,有利于靶向肝脾以外的缺少单核巨噬细胞系统的组织,文献中又称为反向靶向。修饰的药物微粒载体包括:修饰脂质体、长循环脂质体、免疫脂质体、修饰微乳、修饰微球、修饰纳米球、免疫纳米球等。
(1)修饰的脂质体: 脂质体表面经适当修饰后,可避免单核巨噬细胞系统吞噬,延长在体内循环系统的时间,称为长循环脂质体;在脂质体表面接上某种抗体,具有对靶细胞分子水平上的识别能力,可提高脂质体的专一靶向性,称为免疫脂质体;不同的糖基结合在脂质体表面,到体内可产生不同的分布,称为糖基修饰的脂质体,带有半乳糖残基时可被肝实质细胞所摄取,带有甘露糖残基时可被K细胞摄取,氨基甘露糖的衍生物能集中分布于肺内。
(2)修饰的微球: 用聚合物将抗原或抗体吸附或交联形成的微球,称为免疫微球,除可用于抗癌药的靶向治疗外,还可用于标记和分离细胞作诊断和治疗。亦可使免疫微球带上磁性提高靶向性和专一性,或用免疫球蛋白处理红细胞得免疫红细胞,它是在体内免疫反应很小的、靶向于肝脾的免疫载体。
2.前体药物和药物大分子复合物
(1)前体药物:是活性药物衍生而成的药理惰性物质,能在体内经化学反应或酶反应,使活性的母体药物再生而发挥其治疗作用,如抗癌药前体药物、脑部靶向前体药物、结肠靶向前体药物等。欲使前体药物在特定的靶部位再生为母体药物,基本条件是:①使前体药物转化的反应物或酶均应仅在靶部位才存在或表现出活性;②前体药物能同药物的受体充分接近;③酶须有足够的量以产生足够量的活性药物;④产生的活性药物应能在靶部位滞留,而不漏入循环系统产生毒副作用。
(2)药物大分子复合物:是指药物与聚合物、抗体、配体以共价键形成的分子复合物,主要用于肿瘤靶向的研究。
(四)物理化学靶向制剂
物理化学靶向制剂系指应用某些物理化学方法可使靶向制剂在特定部位发挥药效,包括:
磁性靶向制剂、栓塞靶向制剂、热敏靶向制剂和pH敏感的靶向制剂。
1.磁性靶向制剂 采用磁性材料与药物制成磁导向制剂,在足够强的体外磁场引导下,通过血管到达并定位于特定靶区的制剂称为磁性靶向制剂。
2.栓塞靶向制剂 动脉栓塞是通过插入动脉的导管将栓塞物输到靶组织或靶器官的医疗技术。栓塞的目的是阻断对靶区的供血和营养,使靶区的肿瘤细胞缺血坏死,如栓塞制剂含有抗肿瘤药物,则具有栓塞和靶向性化疗双重作用。
3.热敏靶向制剂
(1)热敏脂质体:利用相变温度不同可制成热敏脂质体。将不同比例类脂质的二棕榈酸磷脂(DPPC)和二硬脂酸磷脂(DSPC)混合,可制得不同相变温度的脂质体。在相变温度时,脂质体的类脂质双分子层从胶态过渡到液晶态,增加了脂质体膜的通透性,此时包封的药物释放速率增大,而偏离相变温度时则释放减慢。
(2)热敏免疫脂质体:在热敏脂质体膜上将抗体交联,可得热敏免疫脂质体,在交联抗体的同时,可完成对水溶性药物的包封。这种脂质体同时具有物理化学靶向与主动靶向的双重作用,如阿糖胞苷热敏免疫脂质体等。
4.pH敏感的靶向制剂
(1)pH敏感脂质体:利用肿瘤间质液的pH比周围正常组织显著低的特点,设计了pH敏感脂质体。这种脂质体在低pH范围内可释放药物,通常采用对pH敏感的类脂(如DPPC、十七烷酸磷脂)为类脂质膜,其原理是pH降低时,可导致脂肪酸羧基的质子化形成六方晶相的非相层结构而使膜融合加速释药。
(2)pH敏感的口服结肠定位给药系统:这种结肠溶解的释药系统,也可看作是一种物理化学靶向。如一种治疗便秘的口服结肠胶囊,胶囊的包衣材料组成为1%Eudragit RS、2%Eudragit L、7% Eudragit S、70%乙醇及20%丙酮,口服后到大肠,该包衣材料溶解释药而发挥疗效。

