教师招聘考试化学学科考点:化学能与热能经典题(一)
来源 :中华考试网 2017-08-13
中1.下面各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
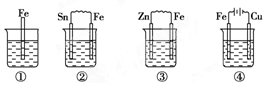
A.④>②>①>③
B.②>①>③>④
C.④>②>③>①
D.③>②>④>①
【解析】铁在海水中的腐蚀属于电化学腐蚀,当钢铁与比它活泼性差的Sn相连,Fe被腐蚀的速率增大比①大,与活泼性强的锌连结,锌作负极,锌被腐蚀,铁被保护,其腐蚀的速率要比①小;在④中,装置为电解装置,Fe为阳极,发生氧化反应,铁腐蚀的速率最快。
【答案】A
2.关于铅蓄电池的说法正确的是 ( )
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)→PbSO4(s)+2e-
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-→Pb(s)+SO42-(aq)
【解析】A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO42-+2e-→PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生氧化反应。
【答案】B
3.下图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
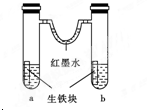
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:Fe→Fe2++2e-
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【解析】生铁中的铁、碳与电解质溶液构成原电池,铁块a为中性环境,发生吸氧腐蚀,氧气被消耗,气体压强减小;b中酸性较强,发生析氢腐蚀,有氢气放出,气体压强增大,所以红墨水柱两边的液面变为左高右低,故B项错。
【答案】B
4.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转变为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
【解析】因为锌锰干电池中锌棒为负极,锌棒变细,碳棒不变,故A错;原电池是将化学能直接转变为电能,所以B错;氢氧燃料电池负极反应为H2→2H++2e-,所以C正确;太阳能电池采用硅材料制作,D错误。
【答案】C
5.将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
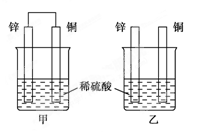
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
【解析】本题考查了置换反应和原电池原理的有关知识,甲中构成了铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为Zn+H2SO4===ZnSO4+H2↑,原电池的构成加快了反应速率;乙中发生置换反应Zn+H2SO4===ZnSO4+H2↑,所以C正确。
【答案】C
6.我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为:4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )
A.正极反应为:O2+2H2O+4e-→4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需更换铝板就可继续使用
【解析】此电池在工作时,电子是由铝电极沿导线流向铂电极的,电流方向是电子流动的反方向,应是由铂电极沿导线流向铝电极。
【答案】B
7.将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,称为燃料电池,下列叙述正确的是( )
①通入CH4的电极为正极;②正极的电极反应是O2+2H2O+4e-→4OH-;③通入CH4的电极反应式是CH4+2O2+4e-→CO2+2H2O;④负极的电极反应式是CH4+10OH-→CO32-+7H2O+8e-;⑤放电时溶液中的阳离子向负极移动;⑥放电时溶液中的阴离子向负极移动。
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
【解析】据题意知发生的反应为CH4+2O2===CO2+2H2O,反应产生的CO2,处于KOH溶液中,又会转化为CO32-,故④是正确的。③O2得e-被还原,作正极。④溶液中离子移动情况受溶液(原电池内电路)中电流方向影响,内电路电流方向是由负极流向正极,阳离子的运动方向与电流方向相同,故在溶液(原电池内电路)中阳离子向正极移动,阴离子向负极移动。
【答案】B
8.碱性锌锰电池工作时的化学方程式为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。关于碱性锌锰电池的说法正确的是( )
A.碱性锌锰电池是二次电池
B.正极反应式为:MnO2+H2O+e-→MnOOH+OH-
C.连续工作后的碱性锌锰电池中电解液的pH将减小
D.工作中,每转移0.2 mol电子时,负极质量减轻6.5 g
【解析】碱性锌锰电池是一次电池,使用完毕后不能进行充电,A错。从总反应方程式可知,反应中消耗了水,因此溶液中OH-浓度增大,pH将增大,C 错。该电池负极反应式为Zn-2e-+2OH-―→Zn(OH)2,可知负极的质量增加,D错。
【答案】B
