2020年青海中考化学练习试题及答案(10)
来源 :中华考试网 2019-12-12
中例1 下列各式中,正确表示实验室制氧气的反应的化学方程式是
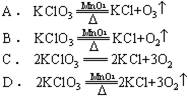
解析:书写正确的化学方程式,首先:要遵循客观事实,要写出正确的化学式。氯酸钾受热生成气体是氧气,氧气的一个分子中有两个氧原子,其化学式为O2。A式中写成O3,这是另一种气体(臭氧)的化学式。其次:要遵循质量守恒定律,方程式要配平,即使等号两边原子的种类、原子的个数一样。B式中表示的氧原子个数反应前后不一样多。第三:完整的方程式要把反应条件在等号上下标出来,把生成物是气体还是沉淀用箭头号标出来。C式中没有写二氧化锰做催化剂、点燃做条件,没有标出反应的产物氧气常温下是气体。
答案:D
例2 对于化学方程式A.氢气加氧气点燃等于水
B.两个氢气和一个氧气点燃生成两个水
C.每4份质量的氢气和32份质量的氧气点燃生成36份质量的水
D.4克氢气和32克氧气点燃生成36克水
解析:任何一个化学符号(包括元素符号、化学式及化学方程式)都具有宏观、微观、质量三方面的含义。对于一个化学方程式,宏观上表示反应物与生成物的种类,即氢气和氧气点燃后生成水,要注意宏观物质只有种类可分,无个数而言,不可读为两个氢气和一个氧气点燃生成两个水。方程式还可表示反应条件,此方程式表示氢气和氧气常温下是不发生这个反应的,必须以点燃为条件。从质量上看,氢气的式量为2,氧气的式量为32,水的式量为18,利用化学式的个数,找出反应物与生成物的质量关系为:氢气∶氧气∶水=4∶32∶16由于化学式的式量是相对质量,单位是1,故叙述时只说几份质量即可,一般不用具体单位克、千克表示。A式中的描述是用数学方法读化学符号。
答案:C
例3 下列描述符合质量守恒定律的是
A.6克碳在5克氧气中充分燃烧可生成11克二氧化碳
B.6克碳与20克氧气充分反应可生成22克二氧化碳
C.3克碳与8克氧气反应生成11克二氧化碳
D.8克碳与16克氧气充分反应生成24克二氧化碳
解析:判断化学反应中的质量关系,应根据方程式计算:
(1)写出正确的方程式 C + O2(2)计算各化学式的质量总和 12 32 44
(3)约简找出最简整数比 3 8 11
当反应物与生成物呈现 C∶O2∶CO2=3∶8∶11时,符合质量守恒定律。有些描述表面上看,给的质量不符合质量关系,那就要看是否有物质过量。如B描述中6克碳充分反应中需16克氧气,题目给20克氧气,将有4克剩余,生成22克二氧化碳仍符合质量守恒定律。
答案:B、C
例4 某物质在空气中燃烧,生成物中只有水和二氧化碳,则该物质的组成是
A.一定有氧元素
B.一定有碳元素
C.一定有碳、氢元素,可能有氧元素
D.一定有碳、氢元素,没有氧元素
解析:某物质可用符号A来表示,依题意可写A+O2答案:C
例5 将2.3克某物质在氧气中燃烧,可得到4.4克二氧化碳和2.7克水,则该物质中
A.一定有碳、氢、氧三种元素
B.一定有碳、氢元素,可能有氧元素
C.一定有碳、氢元素,没有氧元素
D.无法判断
解析:这是一道利用计算确定物质组成的题,该物质可用A表示,该反应可写成A +O2设生成4.4克二氧化碳中含有氧元素质量为x
CO2——2O
44 32
4.4克 x
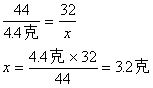
设生成2.7克水中氧元素质量为y
H2O——O
18 16
2.7克 y
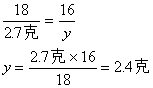
生成物中氧元素总质量=3.2克+2.4克=5.6克
∵5.6>4.8
答案:A
例6 将A、B、C三种物质各10克混和后放入试管中加热,发生如下反应:A+2BA.2.5克 B.5克 C.6克 D.12克
解析:该题是利用质量守恒定律,计算宏观物质质量的习题,要明确与反应式中各物质的系数无关。起始时A、B、C各10克。并非都是反应的。反应后A剩余3克,说明参加反应的有7克;B无剩余,说明参加反应的B为10克;C为22克,说明生成了12克C,由于参加反应的各物质质量总和一定与生成的各物质质量总和相等。故D的质量=7+10-12=5(克)
答案:B
例7 在反应4A+3BA.75 B.24 C.32 D.8
解析:这是一道利用化学方程式,从微观角度计算式量的题,明确计算过程与系数有关。
4A + 3B4×27 3x 2×102
=108 =204
3x=204-108=96
x=32
答案:C
例8 判断化学方程式4x + 5B2 === 4AB2 + 2C2B中,x的化学式为
A.A2C2 B.AC C.A2B D.CA
解析:此题从微观角度判断物质的化学式要注意化学式的个数。根据质量守恒定律,反应前后原子的种类不变,原子的个数也没有增减,此方程式生成物中A原子个数为4,B原子个数为10,C原子个数为4,反应物中5B2恰好提供10个B原子,故4个A原子,4个C原子均由2个x分子提供,一个x分子由两个A原子两个C原子构成。
答案:A
例9 将m个A2分子与n个AB2分子放入集气瓶内密闭加热,使之充分反应后,集气瓶内A与B原子的个数比为
A.无法判断 B.解析:此题不是判断生成物化学式,因此与反应中谁过量无关,由于在密闭容器,反应物的原子个数就是生成物原子的个数,因此m个A2分子共2m个A原子,n个AB2分子共n个A原子2n个B原子,故原子个数比A∶B=(2m+n)∶2n
答案:B
例10 已知氢气与氧气反应的方程式为2H2+O2A.1∶9 B.1∶4 C.1∶5 D.2∶1
解析:原混合气体共10克,若恰好完全反应,则应生成10克水,现生成9克水,说明有1克气体过量,此气体可能是氢气,也可能是氧气。根据生成9克水的客观事实,可求出原气体中氢气与氧气的最小质量:
设生成9克水最少需氢气和氧气的质量分别为x、y
2H2 + O24 32 36
x y 9克

判断:若最少提供1克氢气,氧气为9克,若最少需8克氧气,氢气为2克。
答案:A、B。

