2020年中考化学备考习题(13)
来源 :中华考试网 2019-10-13
中1.(2016•杭州)一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比( )
A.由饱和溶液变为不饱和溶液 B.溶质质量不变
C.溶液质量不变 D.溶质的质量分数减小
【解答】解:A、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,剩余溶液不能继续溶解硝酸钾,仍为饱和溶液,故选项说法错误.
B、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,故选项说法错误.
C、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶液质量减少,故选项说法错误.
D、一杯70℃的硝酸钾饱和溶液,冷却后有晶体析出,溶质的质量减少,溶剂的质量不变,则溶质的质量分数减小,故选项说法正确.
故选:D.
2.(2016•陕西校级二模)20℃时,将硝酸钾饱和溶液100克和200克,分别加热蒸发掉20克水后,冷却到原来的温度,各析出了晶体a克和b克,则a和b的关系是( )
A.a
【解答】解:根据题意“20℃时,分别将200克硝酸钾饱和溶液与100克硝酸钾饱和溶液各蒸发掉20克水后,再降温到20℃,分别析出硝酸钾晶体a克与b克”,所析出晶体的质量均为20℃时20g水所溶解硝酸钾的最大质量,因此析出晶体质量相等,即a=b.所以,A、B、C错误.D正确.
故选:D.
3.(2016•启东市校级自主招生)20℃时将某物质的溶液蒸发60克水后,温度降到20℃,析出无水晶体5克,再蒸发60克水,温度仍降到20℃,又析出无水晶体6克,下列叙述中正确的是( )
A.将原溶液变成饱和溶液,需补充溶质1克
B.20℃时该溶质的溶解度为5克
C.将原溶液变成饱和溶液,需补充溶质6克
D.20℃时该溶质的溶解度为8.3克
【解答】解:解:根据题目信息可知,析出晶体以后溶液就饱和了,比较两次蒸发可以发现,说明60克水和6克晶体组成的溶液是饱和溶液;
设在20℃时该溶质的溶解度为S.
S/100=6/60
解得:S=10克;
∵从第二次蒸发水可以看出,每蒸发60克水,就会析出晶体6克;
但是第一次蒸发掉60克水,就析出晶体5克,说明原来溶液不是饱和溶液;
若原溶液变成饱和溶液在时,则蒸发掉60g水后会析出6g晶体;
故将原溶液变成饱和溶液,需补充溶质6g﹣5g=1g.
故选A.
4.(2016•闵行区一模)t℃时,在饱和硫酸铜溶液中加入a g无水硫酸铜,恢复至原温度可析出b g硫酸铜晶体.说法正确的是( )
A.溶液中溶剂的量不变,颜色不变
B.b g硫酸铜晶体中含硫酸铜的质量大于a g
C.溶质质量分数不变,溶解度变小
D.(b﹣a)g表示原溶液损失的溶质质量
【解答】解:无水硫酸铜加入饱和硫酸铜溶液中,无水硫酸铜会形成硫酸铜晶体,溶液中水减少,所以溶液中的硫酸铜晶体质量也减少.
A、溶液中溶剂的量减少,颜色不变,故A错误;
B、b g硫酸铜晶体中含硫酸铜的质量大于a g,包括了溶液中析出的硫酸铜晶体,故B正确;
C、溶质质量分数不变,温度不变,溶解度不变,故C错误;
D、(b﹣a)g表示原溶液损失的溶质质量和形成硫酸铜晶体结合的水的质量,故D错误.
故选:B.
5.(2016•莱芜)用硫酸铜进行如图所示的实验,对所得溶液的分析正确的是( )
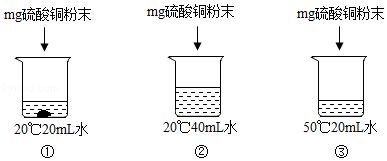
A.三个溶液中溶质溶解度一样
B.②溶液是不饱和溶液
C.③溶液颜色最深
D.温度不同,无法比较①③溶液的溶质质量分数
【解答】解:通过分析可知,①烧杯底部有固体,所以一定属于饱和溶液的是①,②中的溶剂是40mL,③中的溶剂是20mL,①中的硫酸铜会形成硫酸铜晶体,所以溶液中溶剂质量的大小关系是:②>③>①;因为硫酸铜的溶解度随温度的升高而增大,故③溶解的硫酸铜的质量要比①多,质量分数的大小关系是:③>①>②,故③溶液颜色最深.
故选:C.
6.(2016•广东模拟)把400g 20%的氯化钠溶液稀释成10%的溶液,可采取的措施是( )
A.蒸发200g 水 B.加入200g 水
C.加入400g 水 D.加入40g 氯化钠
【解答】解:把400g 20%的氯化钠溶液稀释成10%的溶液,可采用加水稀释的方法;设要加水的质量为x,根据溶液稀释前后,溶质的质量不变,
则400g×20%=(400g+x)×10% x=400g.
A、蒸发200g水,溶质的质量分数会增大,故选项采取的措施错误.
B、根据计算分析,应加入400g水,而不是200g水,故选项采取的措施错误.
C、根据计算分析,应加入400g水,故选项采取的措施正确.
D、加入40g氯化钠,溶质的质量分数会增大,故选项采取的措施错误.
故选:C.
7.(2016•海南校级模拟)在相同温度下,在盛有等质量饱和食盐水和不饱和食盐水的两烧杯中,各放一个完全相同的乒乓球,则下列说法不正确的是( )
A.两烧杯中溶液的溶质质量分数不相同
B.两乒乓球受到的浮力相同
C.乒乓球高出液面的部分相同
D.两烧杯中溶液的导电能力相同
【解答】解:A、在相同的温度下,等质量的饱和食盐水所含的食盐比不饱和食盐水所含食盐的质量要大,所以它们的溶质的质量分数也不同,故A对
B、乒乓球所受的浮力跟其重力相等,由于乒乓球完全相同,所它们受到的浮力也相等,故B对
C、虽然它们受到的浮力相等,但是由于溶液的密度不同,根据F浮=ρ液gV排可知他们排开液体的体积不同,所以高出液面的部分不同,故C错
D、溶液的浓度不同,所含的阴阳离子的浓度就不同,所以这两种溶液的导电能力就不同,故D错
故选CD
8.(2016•宁波校级模拟)Ca(OH)2在80℃时,饱和溶液溶质的质量分数为x,20℃时,饱和溶液溶质的质量分数为y,常压下取80℃时Ca(OH)2饱和溶液a g,蒸发掉w g水,趁热滤去析出的固体,再恢复到20℃,滤液中溶质质量分数为z,则下列关系正确的是( )
A.y=z B.z>x>y C.y>x>z D.x=z
【解答】解:Ca(OH)2在80℃时,饱和溶液溶质的质量分数为x,20℃时,饱和溶液溶质的质量分数为y,氢氧化钙的溶解度随温度升高而减小,故x
常压下取80℃时Ca(OH)2饱和溶液a g,蒸发掉w g水,趁热滤去析出的固体此时还是该温度下的饱和溶液,也就是此时溶质的质量分数为x.再恢复到20℃,此时有高温度下的饱和溶液变成了低温的不饱和溶液,但是溶质和溶剂没有变化,所以溶质的质量分数保持不变,所以x=z
综上所述,z=x
故选D.
9.(2016秋•鸡冠区校级期中)将1 g某物质在室温时溶于20 g水中即达饱和,则一般把这种物质划分为( )
A.易溶物质 B.可溶物质 C.微溶物质 D.难溶物质
【解答】解:1g某物质在室温时溶于20g水中即达饱和,所以某物质的溶解度在室温时为5g,小于10g,大于1g,所以是可溶物质.
故选B
10.(2017•普陀区一模)将10g质量分数为0.1的氯化钠溶液浓度变为0.2,下列操作正确的是( )
A.蒸发5g水
B.加入氯化钠固体0.1g
C.倒出一半溶液
D.加入10g质量分数为0.2的氯化钠溶液
【解答】解:A、蒸发水的质量为y,10*10%/(10-y)×100%=20%,y=5g, B、设加入氯化钠的质量为x,根据题意有10*10%+x/(10+x)×100%=20%,x=1.25g,
C、由于溶液的均一性,倒出一半溶液,溶液的浓度不变;
D、将10g质量分数为0.1的氯化钠溶液加入10g质量分数为0.2的氯化钠溶液,溶液的浓度小于0.2,
故选:A.
11.(2017•沈阳模拟)40g溶质质量分数为20%的NaCl溶液变为10%,下列方法正确的是( )
A.加入8g NaCl固体 B.加入80g水
C.倒掉40g溶液 D.加入40g5%的NaCl溶液
【解答】解:A、加入8gNaCl固体,所得溶液的溶质质量分数是:40*20%+8/(40+8)*100%≈33.3%.故A错误; B、加入80g水,所得溶液的溶质质量分数是:40*20%/(40+8)*100%≈6.67%,故B错误;
C、倒掉40g溶液,不能实现40g溶质质量分数为20%的NaCl溶液变为10%,故C错误;
D、加入40g5%的NaCl溶液,所得溶液的溶质质量分数是:40*20%+40*5%/(40+40)*100%=10%,故D正确.
故选D.
12.(2016•中山市模拟)实验室需要把烧杯A中的氢氧化钠溶液转移到烧杯B中,将烧杯A内的液体倒入烧杯B后,烧杯A内会残留约1mL液体,之后用19mL蒸馏水清洗烧杯A的内壁,这部分液体也倾倒至烧杯B,烧杯A内仍残留约1mL液体…需要几次这样的清洗,才能保证原烧杯中的氢氧化钠溶液99.9%都被转移至新烧杯( )
A.2次 B.3次 C.4次 D.5次
【解答】假设液体密度为1g/ml
第1次清洗倾倒后残留NaOH质量:1g×(1/(1+19))=0.05g=5% 第2次清洗倾倒后残留NaOH质量:1g×(0.05/(1+19))=0.0025g=0.25% 第3次清洗倾倒后残留NaOH质量:1g×(0.0025/(1+19))=0.000125g=0.0125%
而1﹣99.9%=0.1%.
故选B.
13.(2016•杨浦区一模)电解水时,常在水中加入少量的硫酸以增强水的导电性.若用8%的硫酸溶液200g,通以直流电进行电解水实验,过一段时间后,溶液中硫酸的质量分数为10%,则已电解的水的质量为( )
A.10g B.20g C.32g D.40g
【解答】解:通电前后,水的质量减少,反应前后硫酸的质量不变,设已电解的水的质量为x,
则200g×8%=(200g﹣x)×10% x=40g.
故选:D.
14.(2016秋•龙泉驿区校级月考)分别向含相同质量分数、相同质量的稀硫酸中加入下列物质,充分反应后,溶液中溶质质量分数最大的是( )
A.Mg B.MgO C.Mg(OH)2 D.MgCO3
【解答】解:由于Mg+H2SO4=MgSO4+H2↑,MgO+H2SO4=MgSO4+H2O,Mg(OH)2+H2SO4=MgSO4+2H2O,MgCO3+H2SO4=MgSO4+H2O+CO2↑,
98 120 98 120 98 120 98 120
根据化学方程式不难看出,等质量、等溶质质量分数的稀硫酸和这四种物质充分反应后生成的硫酸镁的质量是相等的,即所得溶液中的溶质质量相等,再就是溶液中的溶剂除了稀硫酸中本身含有的水外,只有金属镁和稀硫酸反应时没再生成新的水,也就是它们生成的溶液中水的质量最少.
故选A.
15.(2016•银川一模)20℃NaCl的溶解度是36g,把40g的NaCl加入到20℃的100g水中,充分搅拌,所得溶液中溶质的质量分数是( )
A.36% B.40% C.28.6% D.26.5%
【解答】解:20℃时NaCl的溶解度为36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态,则20℃时将40克NaCl放入到100克水中,最多只能溶解36g,充分搅拌后所得溶液的溶质的质量分数为36/(36+100
)*100%≈26.5%.
故选:D.

