2020年中考化学备考习题(5)
来源 :中华考试网 2019-10-06
中1.右图为测定空气中氧气含量的实验装置.下列有关说法正确的是( )
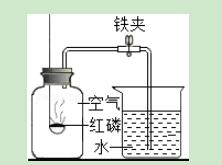
A.燃烧匙中的红磷越多,水位上升越高
B.燃烧匙中的红磷可用硫或木炭代替
C.选用红磷是因为反应可以耗尽O2,生成固态的P2O5
D.本实验可以证明空气含有N2、O2、CO2和稀有气体
【解答】解:A、红磷的量足,能耗尽氧气,当氧气耗尽后,反应停止,水位不会继续上升,故A不正确.
B、因硫或木炭与氧气反应生成物都为气体,不能用于该实验,故B不正确.
C、因红磷能与空气中的氧气反应生成固态P2O5,固体生成物的体积对实验结果几乎没有影响,因此C正确.
D、该实验中红磷只与空气中氧气反应,所以只能确定空气中有氧气,剩余气体的成分不能确定,因此D不正确.
故选C.
2.同学利用如图装置测定空气中氧气的含量,红磷燃烧后恢复到室温,打开弹簧夹发现进入的液体量小于广口瓶内气体体积的五分之一,造成这一现象的原因可能是( )

A.实验前没有夹弹簧夹
B.实验中所取的红磷不足
C.实验中所取的红磷过量
D.实验装置可能未冷却就打开弹簧夹
【解答】解:
A、红磷燃烧是个放热反应,气体受热膨胀,实验前没有将弹簧夹夹紧,燃烧过程中空气逸出,导致到冷却后进入水的量偏大,故A错;
B、实验中所取红磷的量不足时,会导致装置内氧气不能全部消耗,因此使测得氧气的体积分数会小于五分之一,故B正确;
C、实验中所取的红磷过量仍然能完全消耗掉氧气,不影响进入瓶内的液体体积,故C错;
D、装置未冷却就打开弹簧夹,瓶内的气体还处于热膨胀状态,压强大于外界大气压,气体会排出一部分,最后进入集气瓶中的水反而会大于五分之一,此项错误.
故选B
3.如图所示,某同学设计了测定空气中氧气的体积分数的实验.在水槽中盛适量的稀氢氧化钠溶液,并滴入2~3滴酚酞试液,在小木片上固定一只短蜡烛(普通蜡烛1cm,或者生日蜡烛2~3cm),用火柴点燃蜡烛.把集气瓶倒扣在小木块上方,并将瓶口水封.几秒钟后,蜡烛火焰熄灭,水位上升.在水下用玻片盖上集气瓶,取出,量得集气瓶中水的体积小于集气瓶容积的五分之一.以下对此分析不正确的是( )
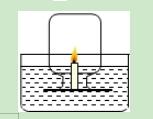
A.滴入2~3滴酚酞试液的目的是让溶液变红,便于观察集气瓶中的水位上升
B.滴入酚酞试液后,一开始溶液变红,随着蜡烛的燃烧,溶液逐渐褪色
C.进入集气瓶中水的体积偏少可能是因为瓶内的氧气没有完全消耗
D.进入集气瓶中水的体积偏少可能是因为随着瓶内的氧气减少,蜡烛发生了不完全燃烧,生成了不能被氢氧化钠溶液吸收的CO等气体
【解答】解:由于空气中氧气含量的测定是要对应的生成物不是气体,而蜡烛燃烧却是能够生成二氧化碳甚至还可能生成一氧化碳,所以实验者设计了用氢氧化钠来吸收二氧化碳的这个细节,所以酚酞的加入虽然开始可以便于观察液面的变化,但是最终目的是证明二氧化碳被吸收.而对于进入液体小于五分之一 ,我们有时会考虑药品的量不足,但是本题中蜡烛熄灭了,说明蜡烛是有剩余的.所以分析时就要注意到这一点.
A、在起始阶段确实便于液面变化的观察,但是后期红色消失,所以便于观察.至于通过颜色变化证明二氧化碳被反应掉,本题的设计是空气成分测定,而不是验证二氧化碳的化学性质.所以目的仅仅是便于观察.正确.
B、开始由于水中有氢氧化钠,所以显红色.后来随着反应的进行,二氧化碳进入溶液从而消耗了溶液中的氢氧化钠,由于生成物为碳酸钠,碳酸钠显碱性,所以依旧是红色.错误.
C、进入集气瓶中水的体积偏少可能是因为瓶内的氧气没有完全消耗.由于燃烧需要氧气达到一定的浓度,所以后期蜡烛熄灭并不代表氧气被完全消耗,所以会导致进入液体体积偏小.正确.
D、其实用蜡烛或者木炭都不可能得到对应的结果,因为这个过程中随着氧气浓度的降低,过程中会生成一氧化碳,虽然可以用氢氧化钠来吸收二氧化碳,但是一氧化碳却无法被吸收.正确.
故答案:B
4.甲、乙两同学分别按图中的图(a)、图(b)装置做质量守恒定律的探究实验.他们俩的做法是:①将反应前的装置放在各自天平的左盘上,往右盘上加砝码使天平平衡.②取下装置,甲挤压胶头,乙将气球内一定量的镁粉倒入瓶中,观察到气球逐渐胀大,最终如图(c)所示.③把装置放回各自的天平上.待天平指针平稳后,两同学天平的指针指向分别是( )

A.甲、乙都偏向右边,但偏差值不同
B.甲、乙都偏向左边,但偏差值不同
C.甲、乙都指向正中
D.甲指向右边,乙指向正中
【解答】解:甲实验中镁粉和稀硫酸酸反应产生的氢气跑掉了,反应后锥形瓶内物质的质量要小于反应前物质的质量,故天平指针向右偏转;乙实验中反应后生成气体使气球内气压增大,气球膨胀,气球体积膨胀,球所受向上的浮力增大,故左边质量变轻,天平指针也向右偏转;由于变轻的质量不同,故偏差值不同.故选A
5.下列有关化学实验的“目的→操作→现象→结论”的描述都正确的是( )
|
选项 |
目的 |
操作 |
现象 |
结论 |
|
A |
比较铝和铜的金属活动性 |
将砂纸打磨过的铝丝 浸入硫酸铜溶液中 |
铝丝表面有铜析出 |
铝比铜活泼 |
|
B |
检验露置在空气中的氢氧化钾溶液是否变质 |
取少量氢氧化钾溶液,滴入澄清石灰水 |
有白色沉淀产生 |
氢氧化钾溶液已经变质 |
|
C |
探究物质溶解于水的热量变化 |
向一定量的水中加入 硝酸铵晶体,充分搅拌 |
溶液温度下降 |
盐类物质溶于水都 能使溶液温度下降 |
|
D |
检验集气瓶中是否集满二氧化碳 |
将燃烧的木条伸入集气瓶中 |
木条火焰熄灭 |
集气瓶中已集满二氧化碳 |
A.选项A B.选项B C.选项C D.选项D
【解答】解:A、铝丝表面有铜析出,应该是结论,因此A答案不正确;
B、滴加入澄清的石灰水会产生白色沉淀,能说明露置在空气中的氢氧化钾中含有碳酸根离子,能说明氢氧化钾溶液已经变质,因此B答案正确;
C、向一定量的水中加入 硝酸铵晶体,充分搅拌时,现象为溶液温度下降,只能得出硝酸铵晶体溶于水时会造成温度降低,其它物质溶于水时无法判断,因此,C答案不正确;
D、检验集气瓶中是否集满二氧化碳时,将燃烧的木条伸入集气瓶中的操作是错误的,因此D答案不正确.
故选B.
6.某化学兴趣小组为探究铁、铜、锌、银的金属活动性顺序,设计了下图所示的三个实验(其中金属均已打磨,且形状、大小相同;所用盐酸的溶质质量分数、用量也相同).下列判断中,错误的是( )

A.通过上述三个实验,不能判断出四种金属的活动性顺序
B.若增加一个铜锌活动性比较的实验,则可判断出四种金属的活动性顺序
C.通过实验①和③的反应剧烈程度,可以判断出铁和锌的金属活动性强弱
D.通过实验的反应现象,可以判断出铜和银的金属活动性强弱
【解答】解:实验①、③中的铁和锌都能与酸反应产生气泡,活动性越强反应越剧烈,锌的金属活动性比铁强,答案C正确;实验②中铜放入硝酸银溶液中会将银置换出来,从而得出铜的活动性比银强,答案D正确;该实验得出结论有锌的金属活动性比铁强,铜的活动性比银强,却没有设计铁的活动性比铜强的实验,因此答案A正确;B答案增加一个铜、锌活动性实验的比较,能得出锌的活动性比铜强的结论,却仍没有设计铁的活动性比铜强的实验,B答案不正确.
故选B.
7.小阳、小安、小璐、小逸四位同学为了探究“盐酸中哪种粒子使紫色石蕊试液变红色”分别设计了下列四个实验方案,其中不合理的是+水
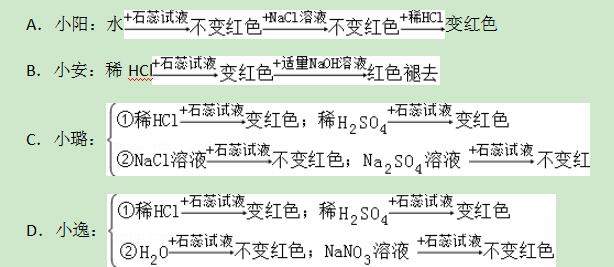
【解答】解:A、由于水中含有水分子,氯化钠溶液中含有氯离子,这两种物质都不能使石蕊试液变红,说明水分子和氯离子不能使石蕊试液变红,从而说明稀盐酸中使紫色石蕊试液变红的粒子是氢离子,故A正确;
B、向滴有紫色石蕊试液的稀盐酸中滴加氢氧化钠溶液,溶液中的粒子发生了改变,水分子和氯离子都没有变化,氢离子没有了,溶液由红色变成了紫色,说明溶液颜色的变化和氢离子有关,故B正确;
C、由于该实验设计只是验证了氢离子和钠离子与石蕊试液混合时的变色情况,并没有证明水分子的情况,故C错误;
D、由于该实验分别设计了水、硝酸钠溶液不能使石蕊试液变红,说明水分子和钠离子不能使石蕊试液变红,稀盐酸和稀硫酸都能使石蕊试液变红,从而说明了氢离子使石蕊试液变红的,故D正确.
故选C.
8.小良同学自制了一种黄色的花汁作指示剂,将花汁加入到不同的试剂中,观察到的现象如下表
|
试剂 |
稀盐酸 |
食醋 |
氢氧化钠溶液 |
食盐水 |
蒸馏水 |
草木灰水 |
|
颜色 |
红 |
红 |
绿 |
黄 |
黄 |
绿 |
小良又用花汁测知家中花盆土壤显酸性,你认为可加入上表中的( )来改良花盆里的土壤.
A.食醋 B.食盐水 C.蒸馏水 D.草木灰水
【解答】解:分析表格信息,氢氧化纳溶液/草木灰水显碱性,可用显碱性的物质改良酸性土壤,但氢氧化纳溶液有腐蚀性,所以只能用草木灰水.
故选D.
9.欲探究久置的生石灰粉末样品的变质情况,下列分析和结论错误的是( )
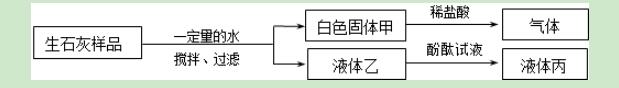
A.液体丙呈红色或无色
B.该样品中一定含有碳酸钙
C.若液体丙呈无色,说明该样品已部分变质
D.白色固体甲可能为Ca(OH)2和CaCO3的混合物
【解答】解:A、向甲中加入稀盐酸时产生气泡,说明固体中含有碳酸钙,则液体乙是水,或氢氧化钙的水溶液,如果是水,则酚酞试液仍然是无色的,如果是氢氧化钙的水溶液,则酚酞试液变红色,即液体丙呈红色或无色,该选项说法正确;
B、因为向甲中加入稀盐酸时产生气泡,说明固体中含有碳酸钙,该选项说法正确;
C、若液体丙呈无色,说明溶液中不含有氢氧化钙,即样品中不含有氢氧化钙和氧化钙,即该样品已全部变质,该选项说法不正确;
D、如果氧化钙完全和水反应生成氢氧化钙,氢氧化钙完全和二氧化碳反应生成碳酸钙,则白色固体甲是碳酸钙,如果氢氧化钙部分和二氧化碳反应生成碳酸钙,
则白色固体甲是Ca(OH)2和CaCO3的混合物,该选项说法正确.
故选:C.
10.某同学检验一瓶NaOH溶液是否变质,设计了下列三种检验方法:①加少量饱和石灰水,有沉淀生成,则氢氧化钠溶液已变质 ②加少量稀盐酸,有气泡产生,则氢氧化钠溶液已变质 ③加少量Ba(OH)2溶液,有沉淀生成,则氢氧化钠溶液已变质.其中方法和结论都正确的是( )
A.只有①和② B.只有②和③ C.只有①和③ D.①②③
【解答】解:
①碳酸钠可以和石灰水产生沉淀,但是氢氧化钠不能,故①对;
②碳酸钠可以和盐酸反应生成气体,而氢氧化钠不能,故②对;
③碳酸钠可以和氢氧化钡反应生成沉淀,而氢氧化钠不能,故③对.
即三种方法都正确,这与选项D相符合.
故选D.
11.如图是实验室里标签破损的一瓶溶液,只能看清“K”和“O4”.某同学对瓶中溶液是什么作了如下猜想,你认为她的猜想一定不合理的是( )
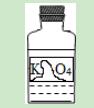
A.高锰酸钾溶液 B.锰酸钾溶液 C.硫酸钾溶液 D.碳酸钾溶液
【解答】解:高锰酸钾、锰酸钾、硫酸钾、碳酸钾的化学式分别是KMnO4、K2MnO4、K2SO4、K2CO3,结合标签中的残留信息“K”和“O4”,可以看出ABC都有可能,而D中的O下标为3不是4(这明显不对),所以ABC合理,D不合理.
故选D
12.某研究性学习小组在整理实验室化学试剂时,发现一盛有无色钠盐溶液的试剂瓶,标签破损,无法确切知道是哪一种钠盐.某同学根据中学化学知识,对该试剂可能是什么进行了如下猜想和验证,选择你认为完全正确的一项是( )
|
序号 |
猜想物质 |
检验需要试剂 |
现象和结论 |
|
A |
Na2SO4 |
氯化钡溶液、稀硝酸 |
如果生成的白色沉淀不溶解,则原溶液一定是Na2SO4溶液 |
|
B |
Na2CO3 |
稀盐酸、 澄清石灰水 |
如果产生的无色气体能使澄清石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
|
C |
Na2SO3 |
稀盐酸 |
如果产生的气体为无色,则原溶液一定是Na2SO3溶液 |
|
D |
NaCl |
硝酸银溶液、稀硝酸 |
如果生成的白色沉淀不溶解,则原溶液一定是NaCl溶液 |
A.A B.B C.C D.D
【解答】解:A.硫酸钠与氯化钡溶液反应生成不溶于稀硝酸的白色沉淀,故正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,则气体为二氧化硫或二氧化碳,所以则原溶液可能是Na2SO3溶液,故错误;
D.滴加硝酸银溶液并加入稀硝酸若有白色沉淀生成,则其是氯化钠溶液,故正确.
故选AD.
13.可园学校化学兴趣小组的同学在实验室发现有一瓶无色溶液,由于保管不当,标签残缺不全.下列分析与判断不正确的是( )
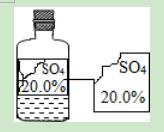
A.这瓶溶液的PH值一定为7
B.这瓶溶液不可能是硫酸铜溶液
C.这瓶液体不可能是碱
D.这瓶溶液中不一定含有金属元素
【解答】解:A、若该瓶溶液是硫酸,则溶液的pH就小于7,故说法错误;
B、该瓶溶液为无色溶液,因此不可能是硫酸铜蓝色溶液,故说法正确;
C、因为阴离子是硫酸根离子,而碱的阴离子是氢氧根离子,因此哪可能是碱,故说法正确;
D、若该瓶溶液是硫酸,则不含有金属元素,故说法正确;
故选项为:A.
14.实验室发现一瓶标签脱落的固体试剂,小王分别制取少量的该固体进行了下列实验.根据实验现象,该固体最可能是( )
|
实验步骤 |
实验现象 |
|
检测水中加入固体前后液体的pH |
固体不溶解,液体pH几乎没变化 |
|
检测盐酸中加入固体前后溶液的pH |
固体溶解,无气体放出,溶液pH增大 |
|
固体灼烧状态下,通入纯净CO |
固体质量减轻,尾气中只检测到CO与CO2 |
A.金属单质 B.碱 C.金属氧化物 D.盐
【解答】解:A、金属单质不能被一氧化碳还原,故选项错误;
B、碱也不能与一氧化碳反应,故选项错误;
C、金属氧化物既可以不溶于水,也可以与盐酸反应,还可以被一氧化碳还原符合实验的现象,故选项正确;
D、一氧化碳与盐也不反应,故选项错误;
故选C.
15.实验室发现一瓶脱落标签的黑色固体试剂,取少量的该固体进行了下列实验.
|
实验步骤 |
实验现象 |
|
检测该固体的水溶性 |
固体不溶解 |
|
检测盐酸中加入固体前后溶液的pH |
固体溶解,无气体放出,溶液pH增大 |
|
固体灼烧状态下,通入纯净CO |
固体质量减轻,尾气中只检测到CO与CO2 |
根据实验现象分析,该固体最可能是( )

A.铁粉 B.木炭 C.氧化铁 D.氧化铜
【解答】解:
A、铁粉不能被一氧化碳还原,且和盐酸反应能够产生气泡,故选项错误;
B、木炭不能被一氧化碳还原,故选项错误;
C、氧化铁既可以不溶于水,也可以与盐酸反应不产生气泡,还可以被一氧化碳还原,但需要高温,灼烧状态下不反应,不符合实验的现象,故选项错误;
D、氧化铜既可以不溶于水,也可以与盐酸反应不产生气泡,还可以被一氧化碳还原符合实验的现象,故选项正确;
答案:D

