2019中考化学模拟试题及解析模拟卷1
来源 :中华考试网 2019-05-09
中一.选择题
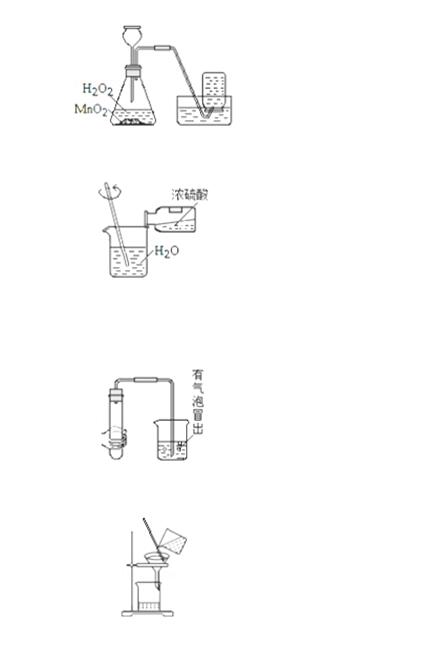
1.以下是初中化学中的一些基本经验,不能达到实验目的是( )
A.
制取氧气
B.
稀释浓硫酸
C.
检查装置气密性
D.
粗盐过滤
考点:氧气的制取装置;浓硫酸的性质及浓硫酸的稀释;过滤的原理、方法及其应用;检查装置的气密性;氧气的收集方法.
专题:常见仪器及化学实验基本操作.
分析:A、根据实验室制取氧气的注意事项进行分析判断.
B、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
C、根据检查装置气密性的方法进行分析判断.
D、过滤液体时,注意“一贴、二低、三靠”的原则.
解答:解:A、实验室用固液常温型制取氧气时,为防止产生的氧气从长颈漏斗中逸出,长颈漏斗的末端应伸入液面以下,图中长颈漏斗的末端没有伸入液面以下,图中所示操作错误.
B、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
C、检查装置气密性的方法:把导管的一端浸没在水里,双手紧贴容器外壁,若导管口有气泡冒出,装置不漏气;图中所示操作正确.
D、过滤液体时,要注意“一贴、二低、三靠”的原则,图中所示操作正确.
故选:A.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.
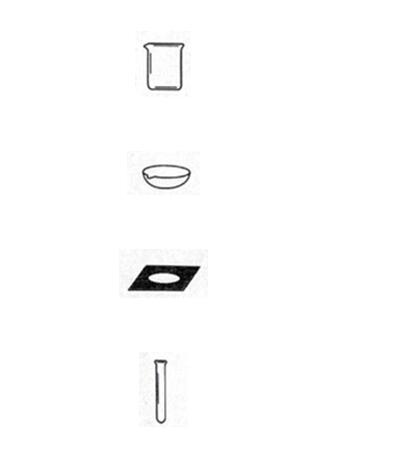
2.在实验室用高锰酸钾制氧气的实验中,必需的仪器是( )
A.
烧杯
B.
蒸发皿
C.
石棉网
D.
试管
考点:氧气的制取装置.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:实验室用高锰酸钾制氧气的装置中,需要使用的仪器有酒精灯、铁架台、试管、带导管的橡皮塞、集气瓶等.
解答:解:实验室用高锰酸钾制氧气的装置中,必需的仪器有装药品高锰酸钾的试管,烧杯可用来加热液体药品、蒸发皿和石棉网用于蒸发操作,故不需要烧杯、蒸发皿、石棉网;
故选:D.
点评:了解高锰酸钾制取氧气的仪器即可顺利解答,烧杯可用来加热液体药品、蒸发皿和石棉网用于蒸发操作.
3.实验室加热高锰酸钾制氧气,可直接采用的发生装置是( )
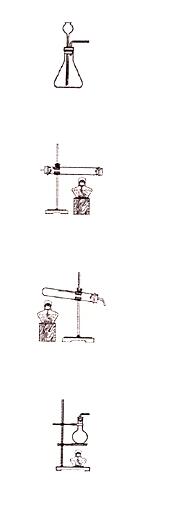
考点:氧气的制取装置.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:A、根据A属于固液常温型解答;
B、根据B可以用于金属矿物的冶炼解答;
C、根据从用加热高锰酸钾的方法制取氧气,反应需要加热;实验室用高锰酸钾制取氧气时,高锰酸钾粉末会随着氧气流顺着导管进入水槽,使水槽内的水变成紫红色(由于高锰酸钾溶于水显紫红色),为防止这种现象的发生,通常要在试管口放一棉花团去分析;
D、根据D属于液体的蒸馏解答.
解答:解:
A、A属于固液常温型;
B、B可以用于金属矿物的冶炼;
C、用加热高锰酸钾的方法制取氧气,在生成氧气的同时,还有锰酸钾和二氧化锰生成,由于反应需要加热,所以发生装置应选C;实验室用高锰酸钾制取氧气时,高锰酸钾粉末会随着氧气流顺着导管进入水槽,使水槽内的水变成紫红色(由于高锰酸钾溶于水显紫红色),为防止这种现象的发生,通常要在试管口放一棉花团;
D、D属于液体的蒸馏装置.
答案:C
点评:实验室制取气体时,发生装置的选择取决于反应物的状态和反应条件;收集装置的选择取决于水溶性和气体的密度;考查了实验室制取氧气的反应原理,及注意事项,是考试的重点也是中考的重点.
4.实验室加热高锰酸钾制氧气,可直接采用的发生装置是( )
考点:氧气的制取装置.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:实验室用高锰酸钾制取氧气,属于固体加热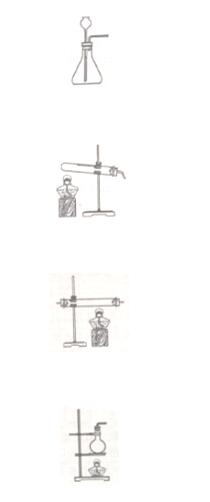 型制取气体,据此进行分析解答.
型制取气体,据此进行分析解答.
解答:解:高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,属于固体加热型制取气体.
A、图中所示制取装置为固液常温型装置,实验室加热高锰酸钾制氧气不能选用该装置,故选项错误.
B、图中所示制取装置为固体加热型装置,故选项正确.
C、图中所示制取装置两端开口,不能用于实验室加热高锰酸钾制氧气,故选项错误.
D、图中所示制取装置不能用于实验室加热高锰酸钾制氧气,否则冷凝水会回流到热的烧瓶底部,使烧瓶底部炸裂,故选项错误.
故选:B.
点评:本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气反应原理、发生装置的选择依据是正确解答本题的关键.
5.实验室用如图所示装置制取氧气,下列有关说法不正确的是( )
A.试管中加入的药品是MnO2和H2O2
B.实验前应检查装置的气密性
C.待导管口产生连续均匀的气泡时才开始收集氧气
D.实验结束时应先从水槽中取出导管,再停止加热
考点:氧气的制取装置;制取氧气的操作步骤和注意点.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:A、根据该装置制取氧气的反应物是固体,反应条件是加热进行分析;
B、根据实验的第一步是检查装置的气密性进行分析;
C、根据收集氧气的正确时刻进行分析;
D、根据收集完成后,先把导管移出水面,再熄灭酒精灯,可以防止水倒流而炸裂试管进行分析.
解答:解:A、该装置制取氧气的反应物是固体,反应条件是加热,故A错误;
B、检查装置气密性是实验必做的一步操作,故B正确;
C、开始产生的氧气不纯,当气泡连续且均匀冒出时氧气纯净,故C正确;
D、收集完成后,先把导管移出水面,再熄灭酒精灯,可以防止水倒流而炸裂试管,故D正确.
故选:A.
点评:本考点考查了氧气的制取方法、操作步骤和收集方法,要加强记忆有关的知识点,并理解应用,本考点主要出现在选择题和实验题中.
6.如图所示实验操作正确的是( )

A.
收集氧气B.
测溶液pHC.
取用液体D.
稀释浓硫酸
考点:氧气的收集方法;液体药品的取用;浓硫酸的性质及浓硫酸的稀释;溶液的酸碱度测定.
专题:常见仪器及化学实验基本操作.
分析:A、根据用向上排空气法收集氧气的注意事项,进行分析判断.
B、根据用pH试纸测定未知溶液的pH的方法进行分析判断.
C、根据向试管中倾倒液体药品的方法进行分析判断.
D、根据浓硫酸的稀释方法(酸入水,沿器壁,慢慢倒,不断搅)进行分析判断.
解答:解:A、用向上排空气法收集氧气时,导管应伸到集气瓶的底部,以利于空气的排出,图中导管没有伸到集气瓶的底部,图中所示操作错误.
B、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误.
C、向试管中倾倒液体药品时,瓶塞要倒放,标签要对准手心,瓶口紧挨;图中瓶口没有紧挨、瓶塞没有倒放、标签没有向着手心,所示操作错误.
D、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
故选:D.
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.
7.下列图标的实验操作正确的是( )
A.
氧气验满
B.
取用药品
C.
称取NaCl
D.
稀释浓硫酸
考点:氧气的检验和验满;称量器-托盘天平;固体药品的取用;浓硫酸的性质及浓硫酸的稀释.
专题:常见仪器及化学实验基本操作.
分析:A、根据氧气验满的正确方法分析;
B、根据药品具有腐蚀性分析;
C、根据托盘天平的使用要遵循左物右码的原则;
D、根据稀释浓硫酸的正确方法分析.
解答:解:A、验满时,应将带火星的木条放在集气瓶口,木条复燃,说明氧气已满,故操作错误;
B、药品具有腐蚀性,不可用手直接取用,故操作错误;
C、托盘天平的使用要遵循左物右码的原则,而且氯化钠不可直接放在托盘中,操作错误;
D、稀释浓硫酸时,把浓硫酸慢慢注入水中,并不断搅拌,故操作正确.
故选D.
点评:要熟记课本常见实验的基本操作方法、步骤,不要在做实验时进行错误操作.否则会带来一些不安全因素.
8.下列有关实验操作及分析均合理的是( )
A.排水法收集O2:导气管口刚有气泡冒出立即收集,收集到的O2更纯净
B.去除粗盐中难溶性杂质:将粗盐全部加入水中立即过滤,导致产率偏低
C.测定空气里O2含量:点燃红磷慢慢伸入集气瓶并塞紧瓶塞,导致测定结果偏低
D.探究CO2性质:将CO2快速倒入盛有燃着蜡烛的烧杯中,便于观察低处蜡烛先熄灭
考点:制取氧气的操作步骤和注意点;空气组成的测定;二氧化碳的化学性质;氯化钠与粗盐提纯.
专题:常见仪器及化学实验基本操作.
分析:A、根据刚有气泡冒出时,收集的气体不纯解答;
B、根据去除粗盐中难溶性杂质:将粗盐全部加入水中,立即过滤,可能没有全部溶解解答;
C、根据由于插入燃烧匙太慢,在塞紧瓶塞之前,瓶内部分空气受热逸出,使瓶内的气体除氧气之外的气体也跑到了瓶外解答;
D、根据探究CO2性质:将CO2慢慢倒入盛有燃着蜡烛的烧杯中解答.
解答:解:
A、导管口刚有气泡冒出立即收集,此时收集的气体中混有空气,会影响气体的性质实验,故错误;
B、去除粗盐中难溶性杂质:将粗盐全部加入水中,立即过滤,可能没有全部溶解,导致产率偏低,正确;
C、由于插入燃烧匙太慢,在塞紧瓶塞之前,瓶内部分空气受热逸出,使瓶内的气体除氧气之外的气体也跑到了瓶外,会导致液体水面上升超过;
D、探究CO2性质:将CO2慢慢倒入盛有燃着蜡烛的烧杯中,便于观察低处蜡烛先熄灭,故错误.
答案:B
点评:这类题目考查了学生思维的开放性,特别是知识的利用有一定的技巧,要填自己有把握的内容.
9.下列实验操作正确的是( )
A.排水法收集氧气时,当导管口开始有气泡冒出时立即收集
B.稀释浓硫酸时,沿烧杯壁将水缓缓注入盛有浓硫酸的烧杯中,并用玻璃棒不断搅拌
C.过滤时,用玻璃棒在过滤器中不断搅拌
D.氢气、甲烷等可燃性气体点燃前进行验纯
考点:制取氧气的操作步骤和注意点;浓硫酸的性质及浓硫酸的稀释;过滤的原理、方法及其应用;氢气、一氧化碳、甲烷等可燃气体的验纯.
专题:常见仪器及化学实验基本操作.
分析:A、根据实验室制取氧气的步骤进行分析判断;
B、根据浓硫酸的稀释方法进行分析判断;
C、根据过滤时的注意事项解答;
D、根据可燃性气体燃烧时易发生爆炸,点燃前进行验纯解答.
解答:解:
A、排水法收集氧气时,不能有气泡冒出立即收集,而是要等到气泡冒出均匀后再收集,故错误;
B、浓硫酸溶于水要放热,所以稀释浓硫酸时要将浓硫酸倒入水中,且用玻璃棒不断搅拌,故错误;
C、过滤时,用玻璃棒引流,不能在过滤器中不断搅拌,以免损坏滤纸,故错误;
D、可燃性气体燃烧时易发生爆炸,点燃前进行验纯,故正确.
答案:D
点评:本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.
10.向一定溶质质量分数的过氧化氢溶液加入少量二氧化锰,立即有大量的氧气产生,下列说法正确的是( )
A.过氧化氢中含有水和氧气
B.过氧化氢能使二氧化锰分解放出氧气
C.二氧化锰能加快过氧化氢分解生成水和氧气
D.该反应中有过氧化氢和二氧化锰两种反应物,不属于分解反应
考点:实验室制取氧气的反应原理;催化剂的特点与催化作用;反应类型的判定.
专题:空气与水.
分析:根据实验室分解过氧化氢制取氧气的反应原理:过氧化氢在二氧化锰的催化作用下分解生成水和氧气,据此进行分析解答.
解答:解:A、过氧化氢中不含水和氧气,故选项说法错误.
B、过氧化氢在二氧化锰的催化作用下分解生成水和氧气,二氧化锰能加快过氧化氢分解生成水和氧气,故选项说法错误.
C、过氧化氢在二氧化锰的催化作用下分解生成水和氧气,二氧化锰能加快过氧化氢分解生成水和氧气,故选项说法正确.
D、该反应中二氧化锰作催化剂,反应前后质量不变,该反应的反应物是过氧化氢,生成物是水和氧气,符合“一变多”的特征,属于分解反应,故选项说法错误.
故选:C.
点评:本题难度不大,掌握实验室分解过氧化氢制取氧气的反应原理、催化作用是正确解答本题的关键.
11.实验室用氯酸钾和二氧化锰制取氧气,有关该实验的说法错误的是( )
A.二氧化锰是反应物
B.与高锰酸钾制取氧气装置相同
C.可用向上排空气法收集
D.可用带火星的木炭检验氧气
考点:实验室制取氧气的反应原理;氧气的收集方法;氧气的检验和验满.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:根据氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,结合反应物的状态和反应条件分析发生装置,根据氧气的密度和溶解性分析收集方法,根据氧气的助燃性分析检验方法.
解答:解:A、氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,其中的二氧化锰作为反应条件,是催化剂,故说法错误;
B、氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,和加热高锰酸钾制取氧气都是固体加热型的发生装置,故说法正确;
C、因为氧气的密度比空气大,因此可以采用向上排空气法收集,故说法正确;
D、氧气具有助燃性,因此可以使带火星的木炭复燃用来检验氧气,故说法正确;
故选项为:A.
点评:本题考查气体正确和收集装置的选择及氧气的检验方法,选择发生装置时,要考虑反应物的状态、反应条件等因素;选择收集装置时,要考虑气体的水溶性、密度、能否和空气中的物质发生化学反应等因素,属于基础性的考查.
二.解答题
1.如图是氧气的制取与性质实验装置图.
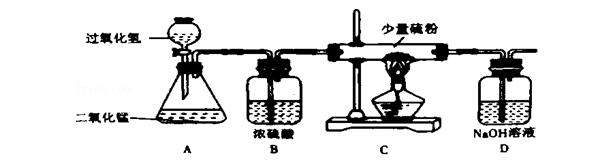
回答下列问题:
(1)装置B的作用是 ,装置C中硫粉燃烧的现象是 ,装置D的作用是 .
(2)装置A中发生反应的化学方程式为 ,装置D中发生反应的化学方程式为 .
考点:氧气的制取装置;氧气的化学性质;氧气的收集方法;书写化学方程式、文字表达式、电离方程式.
专题:常见气体的实验室制法、检验、干燥与净化.
分析:(1)装置B的药品是浓硫酸,浓硫酸具有吸水性;硫粉燃烧生成二氧化硫气体,二氧化硫气体能与氢氧化钠溶液反应生成亚硫酸钠和水,据此进行分析解答.
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,写出反应的化学方程式即可;
解答:解:(1)装置B的药品是浓硫酸,浓硫酸具有吸水性,装置B的作用是除去水蒸气(干燥气体或吸收水分).
装置C中硫粉燃烧的现象产生蓝紫色火焰,硫粉燃烧生成二氧化硫气体,二氧化硫气体能与氢氧化钠溶液反应生成亚硫酸钠和水,则装置D的作用是吸收二氧化硫,防止污染空气.
(2)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2
2H2O+O2↑.
装置D中发生反应的化学方程式为SO2+2NaOH=Na2SO3+H2O.
故答案为:(1)除去水蒸气(干燥气体或吸收水分);产生蓝紫色火焰;吸收二氧化硫,防止污染空气;
(2)2H2O2
2H2O+O2↑;SO2+2NaOH=Na2SO3+H2O.
点评:本题难度不大,是中考的重要考点之一,熟练掌握实验室中制取氧气的反应原理、氧气的化学性质等是正确解答本题的关键.
2。(1)实验室给你提供了下列仪器,请选用合适的仪器完成指定的实验.

①图中仪器d的名称是: .
②要制取较多的O2用来探究其性质(要求制取过程中可以添加反应物),组装气体发生装置需要的仪器是 (填序号,下同),请写出该反应的化学方程式 ,收集氧气应采用 法,这种收集方法是根据氧气的 性质.
③提纯粗盐时,过滤需要选用上述仪器中的 (填序号),除此之外还缺少的仪器是滤纸、 、 (填名称).
(2)为探究气体X的组成,某兴趣小组进行如图所示实验(固定装置未画出).
【资料在线】
①加热条件下,气体X能与氧化铜反应生成铜、水和氮气.
②碱石灰为固体氢氧化钠和氢氧化钙的混合物,不与气体X反应.无水氯化钙可吸收气体X.
③本实验条件下,氮气密度为1.15g•L﹣1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计.【实验步骤】
①连接仪器,并检查装置气密性.
②取一定量氧化铜,准确称得其质量为2.40g.
③按图所示装入药品(其中B、C管中分别装入的是足量碱石灰和足量无水氯化钙),测并记录相在数据Ⅰ(见表).
④连接A、B、C装置,将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热.当A装置中氧化铜反应完全,停止加热,继续通入气体X至玻璃管冷却后,再次测量并记录相关数据Ⅱ(见表).
【实验装置】
【相关数据】
测量项目/数据编号ⅠⅡ
玻璃管(含药品)的质量/g52.4051.92
B装置(含药品)的质量/g102.00102.54
氮气的体积/mL/243.5
【回答问题】
①B中装置中氧化钙吸水的原理为 (用化学方程式表示).
②实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 .
③分析实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g.由此推知,气体X中一定 (填“有”或“没有”)氧元素.
④通过计算推导出气体X的化学式为 ;气体X还原氧化铜的化学方程式为: .
考点:氧气的制取装置;实验探究物质的组成成分以及含量;过滤的原理、方法及其应用;常见气体的检验与除杂方法;氧气的收集方法;书写化学方程式、文字表达式、电离方程式.
专题:常见气体的实验室制法、检验、干燥与净化;科学探究.
分析:长颈漏斗方便加液体药品,制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.过滤用到的仪器有:烧杯、漏斗、玻璃棒、铁架台.B中装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙;实验过程中,当观察到:D装置中量气管的液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是:防止空气进入把生成的铜氧化,造成误差;分析实验测量的数据,生成水的质量=102.54g﹣102.00g=0.54g;氧化铜中氧元素的质量=52.40g﹣51.92g=0.48g;由此推知,气体X中一定没有氧元素,因为0.54g水中含氧元素0.48g;通过计算推导出气体X是氨气,氨气和氧化铜在加热的条件下生成铜和水和氮气,配平即可.
解答:解:(1)①长颈漏斗方便加液体药品,故答案为:长颈漏斗;
②如果用双氧水和二氧化锰制氧气就不需要加热,要求制取过程中可以添加反应物,因此组装气体发生装置需要的仪器是:adf;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:adf;2H2O2
2H2O+O2↑;向上排空气法;密度比空气的密度大;
③过滤用到的仪器有:烧杯、漏斗、玻璃棒、铁架台;故答案为:eh;漏斗、玻璃棒;
(2)①B中装置中氧化钙吸水的原理为:氧化钙和水反应生成氢氧化钙;故答案为:CaO+H2O=Ca(OH)2;
②实验过程中,当观察到:D装置中量气管的液面不再下降,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是:防止空气进入把生成的铜氧化,造成误差;故答案为:D装置中量气管的液面不再下降;防止空气进入把生成的铜氧化,造成误差;
③分析实验测量的数据,生成水的质量=102.54g﹣102.00g=0.54g;氧化铜中氧元素的质量=52.40g﹣51.92g=0.48g;由此推知,气体X中一定没有氧元素,因为0.54g水中含氧元素0.48g;故答案为:0.54;0.48;没有;
④通过计算推导出气体X是氨气,氨气和氧化铜在加热的条件下生成铜和水和氮气,配平即可;故答案为:NH3;2NH3+3CuO
3Cu+3H2O+N2;
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写、过滤操作、实验探究和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

