2019年中考化学模拟试题:酸碱盐测试题
来源 :中华考试网 2019-02-11
中一、 选择题(以下各题只有一个符合要求的答案,每题1分,共15分)
1.为合理利用“垃圾’’资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐
以归为一类加以回收,它们属于 ( )
A.有机物 B.无机盐 C.金属或合金 D.难溶性碱
2.将铁钉置于下列四种环境中,容易生锈的是 ( )
A.置于潮湿的空气中 B.置于干操的空气中
C.浸没于煮沸的水中 D.浸没于油中
3.能一次性鉴别NaCl、BaCl2、Na2CO3,三种无色溶液的试剂是 ( )
A.稀硫酸 B.盐酸 C.石灰水 D.硝酸银溶液
4.—些食物的近似pH如下:葡萄3.5——4.5,苹果2.9,——3.3,牛奶6.3,——6.6,鸡蛋清7.6——8.0。下列说法错误的是( )
A.胃酸过多的人不应多食苹果 B.苹果汁的酸性比葡萄汁强
C.鸡蛋清是碱性食物 D.葡萄汁能使紫色石蕊试液变蓝
5.下列药品未经密封保存,敞口放置一段时间后,质量增加并发生化学反应的是( )
①苛性②碳酸 ⑧浓盐酸 ④浓硫酸 ⑤熟石灰
A.①⑧ B.②④ C.①⑤ D.④⑤
6.我国著名化学家侯德榜先生作出的重大贡献是( )
A.发明黑火药 B.创造湿法冶金
C. 改进纯碱的生产 D.发现了新元素
7.现有①Ba(NO3)2:溶液、②KCI溶液、⑧K2SO4溶液、④CuSO4溶液,不用其他试剂,可通 过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是 ( )
A.①②⑧④ B.①④⑧② C.④⑧②① D.④①⑧②
8.向盛有Fe、Cu的烧杯中加入过量稀硫酸,所得溶液中的溶质有( )
A.1种 B.2种 C 3种 D 4种
9.CuCI2和MgCl2的混合溶液中加入过量锌粉,充分反应后过滤,留在滤纸上的物质是( )
A.Zn B.Cu C.Zn和Cu D.Cu和Mg
10.不符合“酸和盐反应生成另一种酸和另一种盐”的反应是 ( )
A.盐酸和硝酸钠溶液 B.稀硫酸和氯化钡溶液
C.稀盐酸和硝酸银溶液 D.硝酸和碳酸钙
11.某工厂排放的五色废水经测定PH=2,为治理废水,需将此废水的PH调至7~8,为达此目的,并采用经济可行的方法,需在此废水中加入( )
A.生石灰 B.氢氧化钠 C.铁粉 D.盐酸
12.以铁矿石(含Fe203)为原料炼铁时,一氧化碳是( )
A.氧化剂 B.还原剂 C.催化剂 D.燃料
13.某溶液中含Fe3+,Mg2+,S042-,NO3-,其中Fe3+,Mg2+,S042-的个数比为3:3 :1,可推知溶液中Fe3+,S042-,N03-的个数比是( )
A.3:2:1 B.1:2:1 C.3:1:15 D.3:1:13
14.分别取少量下列各组物质同时加到足量水中,得到无色透明溶液的是 ( )
A.FeCI3 、Ba(OH)2、KNO3, B.Na2CO3、CaCl2、Zn(NO3)2
C.CuS04、KCI、NaCI D.MgCl2、NaN03、Na2S04
15.欲除去括号内的少量杂质,选用试剂不正确的是( )
A.NaOH溶液(Na2CO3)选用稀盐酸· B.C(CuO)选用稀硫酸
C.NaCl溶液[Ba(OH)2]选用硫酸铜溶液 D.MnO2(KCl)选用水
二、选择题(以下各题各有一个符合要求的答案,每题2分,本题共10分)
16.把足量的铁粉,分别加入到下列各组物质的溶液中,充分反应过滤,滤液中只有的是 ( )
A.Na2S04 CuSO4, B.H2SO4 CuS04 C.HCl H2SO4 D.CuCl2 Cu(N03)2
17.在下列物质与盐酸反应后所得的溶液中,加入氢氧化钠溶液,能产生红褐色沉淀的是
A.Fe B.Fe2O3 C.CuO D.FeO
18.将下列各组物质分别放入水中,有化学反应发生,但既无沉淀生成,又无气体放出的是( )
A.CaCl2、KOH、Na2C03 B.NazC03、BaCl2、HCI C.K2SO4、HCI、NaOH D.CuS04、HCl、NaCl
19.将一根洁净的铁钉放入稀硫酸中,有:①在铁钉表面产生气泡;②溶液由无色逐渐变成浅绿色;⑧铁钉的质量减轻;④溶液的质量增加,以上叙述中正确的是 ( )
A.①②⑧ B.①⑧④ C。①④ D.①②⑧④
20.甲化工厂排放的酸性污水和乙化工厂排放的污水,共含有以下6种离子中的各3种:K+、
OH-、C03 2-、Ba2+、H+、NO3-,则乙化工厂排放的污水中所含有的3种离子是 ( )
A.K+、OH-、H+ B.K+、OH-、C03 2- C.Ba2+、OH-、NO3- D.OH-、K+、Ba2+
三、选择题:以下各题,有1~2个选项符合题意(每题2分,本题共10分)
21.滴有酚酞的氢氧化钡溶液与下列各物质恰好完全反应后,溶液仍显红色的是 ( )
A.C02 B.Na2CO3 C.H2S04 D.Na2SO4
2下列各组物质的转化能实现的是( )
A.BaCO3→BaCI2(溶液)→BaCO3↓ B.CaCO3→CaO→Ca(OH)2(溶液)→NaOH(溶液)
C. Cu→Cu0→Cu(OH)2→CuSO4(溶液) D.Fe2O3→Fe→FeCI3(溶液)→Fe(OH)3
23.为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2mI试样于试管中,而后进行如下实验,其中丕能达到目的的是( )
A.加入少量盐酸, 观察现象 B.加入澄清石灰水,观察现象
C. 加入氯化钡溶液,观察现象 D.通适量CO2气体,观察现象
24. 分别表示三种物质,则X代表的物质是 ( )
A.Cu B.Fe203 C.Ba(OH)2溶液 D.AgN03溶液
25.一包白色固体可能由碳酸钠、硫酸钾、氯化钠中的一种或几种组成,取式样少许溶于水,加入过量的
氯化钡溶液,产生白色沉淀,该沉淀不溶于稀硝酸。过滤,在滤液中加入用硝酸酸化的硝酸银溶液产生白色沉淀,则原固体物质的组成中( )
A.一定有K2SO4 B. 一定有NaCl C.一定有Na2CO3 D.可能有NaCl
四、填充题(本题共40分)
26.(4分)制作松花蛋所用的配料主要有纯碱、食盐、生石灰、草木灰(主要成分是碳酸钾)、水等物质,制作时需要将它们混合并充分搅拌,根据所学知识写出能反应的化学方程式:————————————————————————————————————————————————
27.(2分)铁制品放入稀盐酸中除锈时,溶液变黄,并常有气泡产生,有关化学反应的方程式是
① ____________________________________________________________
② ____________________________________________________________
28. (2分) 将一根光亮的铁丝插入硫酸铜溶液中,过一会儿取出,铁丝表面覆盖一层红色的物质是______ ,这说明铁的金属活动性比铜______ 。
29.(2分)向水中加入 ______ 或 _______ 物质后会产生放热现象。
30. (4分)在一张洁白干燥的滤纸上依次喷洒 A、B、C三种无色液体,当喷洒A时滤纸无明显变化,再喷洒B时滤纸上显出一间红色小屋,最后喷洒C时红色小屋又消失了,回答下列问题:滤纸上的小屋事先是用______试剂画出的。无色溶液A是_______ ; B是________ ; C是_______ 。
32. (5分)用化学方程式说明下列事实:
(1)露天堆放的生石灰逐渐变质 ____________________________________
(2)工业上用纯碱和熟石灰制取烧碱 ________________________________
(3)向纯碱中加入盐酸,有大量气体放出 _____________________________
(4)锅炉中的水垢可以用盐酸来清洗 _______________________________
(5)铁钉放在硝酸汞溶液中表面会产生一种银白色的物质 _____________________________________
33. (9分)硫酸铜与某些物质能发生反应,请写出3个化学方程式和实验现象,并分别说明在生产生活中的用途。
|
|
化学方程式 |
现象 |
用 途 |
|
(1)与金属 |
|
|
|
|
(2)与碱 |
|
|
|
|
(3)与盐 |
|
|
|
回答:(1)第一步实验中观察到的实验现象是 _________________________ ;
(2) 第三步实验中滤纸上A是 ___________ ,滤纸中B是 ________________;
(3)第四步实验中加入过量的C溶液是 __________ ,其目的是 ___________。
五、简答题(本题共4分)
35.(4分)已知盐酸溶酸中含有水分子(H:O)、氯离子(Cl—)和氢离子(H’),该溶液能使紫色石蕊试液变红色。请你猜想在盐酸溶液中可能是哪一种微粒使紫色石蕊试液变红色?并设计实验验证你的猜想,写出简要的实验步骤,观察到的现象以及由此得出的结论。猜想:________________________________________
|
实 验 步 骤 |
实 验 现 象 |
实 验 结 论 |
|
|
|
|
六、推断题(本题共21分)
36.(5分)某实验室的废液中,可能含有氯化铁、硫酸、硫酸钠、氯化钠、氢氧化钠、碳酸 钠和硝酸钡中的一种或多种。初三化学课外活动小组的同学对废液进行了如下试验:
(1)取废液观察,为无色溶液;
(2)取废液,向其中滴加氯化钡溶液,有白色沉淀产生,继续加入稀硝酸,无明显现象;
(3)另取废液,向其中加入铁粉后,产生大量气泡。
根据以上试验现象可推断,废液中肯定含有___________,肯定不含有____________,不能确定是否含有_______________ 。
37.(5分)用铁屑、铜粉、高锰酸钾、稀盐酸四种物质为原料,采取两种不同的方法制取氯化亚铁,请写出各步化学方程式。
38.(11分)古都南京的地铁建设已经破土动工。考古兴趣小组为了研究从地铁建设工地出土的文物,对两件文物的表面物质A和B进行了如图所示的实验:
TON
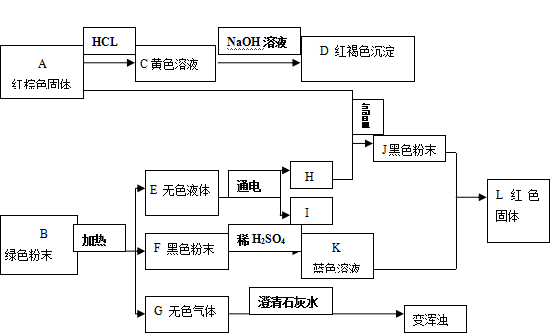
(1)请你根据上图实验现象推断下列物质的化学式:
B ________ ; C __________ ; D _________ ; E _________ ; F __________ ; G __________ ; J ____________
(2) 写出下列转换的化学方程式:C → D ___________________________________ ;
E →H+I __________________________________;
J + K→L __________________________________。
(3) 在博物馆例很少见到由J制造的完好文物,原因是什么?
_______________________________________________________________ 。
初三化学酸碱盐单元测试题参考答案
选择题
|
题号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
答案 |
C |
A |
A |
D |
C |
C |
D |
B |
C |
A |
A |
B |
D |
|
题号 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
答案 |
D |
A |
B |
B |
C |
D |
B |
BD |
B |
AD |
BD |
AD |
|
四、填充题(每空1分)
26. CuO+H2O=Ca(OH)2
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH K2CO3+Ca(OH)2=CaCO3↓+2KOH
27. ①Fe2O3+6HCl=2FeCl 3+3H2O ②Fe+2HCl=FeCl2+H2↑
28. Cu、 强 29. CaO 浓H2SO4. NaOH
30. 酚酞或NaOH溶液 水 NaOH溶液或酚酞 酸溶液H2SO4
31. (答案略)
32. ⑴ CaO+H2O=Ca(OH)2 Ca(OH)2+CO2=CaCO3↓+H2O
⑵ Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
⑶ Na2CO3+2HCl=2NaCl+CO2↑+H2O
⑷ CaCO3+2HCl=CaCl2+H2O+CO2↑
⑸ Fe+Hg(NO3)2=Fe(NO3)2+Hg
33.
|
|
化学方程式 |
现 象 |
用 途 |
|
⑴与金属 |
CuSO4+Fe=FeSO4+Cu |
铁表面有红色金属 |
湿法炼铜 |
|
⑵与碱 |
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ |
生成蓝色↓ |
检验Cu2+或OH- 沉淀Cu2+、OH- |
|
⑶与盐 |
CuSO4+BaCl2=BaSO4↓+CuCl2 |
生成白色↓ |
检验SO#FormatImgID_1#或Ba2+沉淀SO#FormatImgID_2#、Ba2+ |
34. (1)黑色粉末溶解生成蓝色溶液
(2)Fe、Cu, FeSO4 (3) H2SO4, 除去过量的铁
五、简答题(每空1分)
猜想:H+能使紫色石蕊变红
|
实验步骤 |
实现现象 |
实验结论 |
|
在水中滴入紫色石蕊 在NaCl等可溶性氯化物溶液中滴入紫色石蕊 |
不变色 不变色 |
H2O不能使石蕊变红 Cl-不能使石蕊变红,盐酸中能被石蕊变红的是H+ |
六、推断题(第1空1分,后两空每空2分)
36. H2SO4, FeCl3 Ba(NO3)2 NaOH Na2CO3, NaCl Na2SO4
37. (每个方程式1分)
2KMnO4K2MnO4+MnO2+O2↑ Fe+2HCl=FeCl2+H2↑ 2Cu+O2 2CuO CuO+2HCl=CuCl2+H2O
Fe+CuCl2=FeCl2+Cu
38. (每空1分)
(1) B、Cu2(OH)2CO3 C、FeCl3 D、Fe(OH)3 E、H2O
F、CuO G、CO2 J、Fe
(2) C→D、FeCl3+3NaOH=3NaCl+Fe(OH)3↓
E→H+I、2H2O 通电 2H2↑+O2↑ J+K→L、Fe+CuSO4=FeSO4+Cu
(3)化学性质较活泼,易被氧化

