往50mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末
来源 :焚题库 2021-08-06
中简答题 往50mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末,充分反应后进行过滤,滤液的pH=13,其沉淀干燥后质量为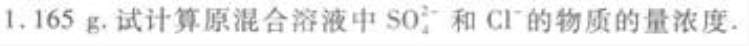
参考答案:加入的Ba(OH)2的物质的量为
所得的沉淀是BaSO4,其物质的量为 
解得
x=y=0.005 
(2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。
n(OH-)=0.1mol/L×0.05L=0.005mol
设剩余的Ba(OH)2为zmol,则 
即剩余Ba(OH)20.0025mol。
与HCl反应的Ba(OH)2的物质的量为0.0125mol-0.005mol-0.0O25mol=0.005mol
设溶液中HCl(Cl-)的物质的量为mmol,则 

(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(3)因滤液的pH=13,可知Ba(OH)2与H2SO4、HCl反应后,仍有剩余。即加入的Ba(OH)2分为三部分:①与H2SO4反应,②与HCl反应,③剩余。根据BaSO4的物质的量可求出H2SO4消耗的Ba(OH)2,根据剩余溶液的pH=13可求得剩余的Ba(OH)2。所以用Ba(OH)2的总量,减去H2SO4消耗的量,再减去剩余的量,最后可得与HCl反应的Ba(OH)2的物质的量,并进一步由Ba(OH)2的物质的量求得HCl的物质的量。
答案解析:
相关知识:化学:第一部分、基本概念和原理


