2016云南高考理综试题答案解析(word版)
来源 :中华考试网 2016-08-12
中2016年高考新课标III卷理综化学试题
7.化学在生活中有着广泛的应用,下列对应关系错误的是
| Al2(SO2)3化学性质 | 实际应用 | |
| A. | 和小苏打反应 | 泡沫灭火器灭火 |
| B. | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C. | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D. | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
【答案】B

考点:盐类水解的应用,氧化还原反应,次氯酸的性质,二氧化硅的性质
8.下列说法错误的是
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸在甲酸甲酯互为同分异构体
【答案】A
【解析】
试题分析:A、乙烷和浓盐酸不反应,故错误;B、乙烯可以制成聚乙烯,用于食品包装,故正确;C、乙醇含有亲水基羟基,能溶于水,而溴乙烷不溶于水,故正确;D、乙酸和甲酸甲酯的分子式相同,结构不同,是同分异构体,故正确。
考点:烷烃的性质,烯烃的性质和用途,乙醇的性质,溴乙烷的性质,同分异构体
9.下列有关实验的操作正确的是
| 实验 | 操作 | |
| A. | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| B. | 排水法收集KMnO4分解产生的O2 | 先熄灭酒精灯,后移出导管 |
| C. | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
| D. | CCl4萃取碘水中的I2 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
【答案】D

考点:浓硫酸的稀释,气体除杂,萃取操作

【答案】C

考点: 原电池和电解池的工作原理
12.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A.简单离子半径:W< X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
【答案】B
【解析】
试题分析:X的原子半径是短周期主族元素原子中最大的,为钠元素,ZX形成的化合物为中性,说明为氯化钠,则Y为硫元素,W为氧元素。A、钠离子和氧离子电子层结构相同,核电荷数越大,半径越小,故钠离子半径小于氧离子半径,故错误;B、氧和钠形成的化合物为氧化钠或过氧化钠,其水溶液都为氢氧化钠,显碱性,故正确;C水和硫化氢比较,水稳定性强,故错误;D、最高价氧化物对应的水化物中高氯酸是最强酸,故错误。
考点: 原子结构和元素周期律的关系
13.下列有关电解质溶液的说法正确的是

【答案】D

考点: 弱电解质的电离平衡,盐类水解平衡,难溶电解质的溶解平衡
26.(14分)
过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
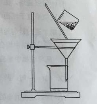
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
【答案】(1)调节溶液pH使Fe(OH)3沉淀;过滤分离 (2)ade(3)酸;除去溶液中溶解的CO2
(4)CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O;温度过高时过氧化氢分解
(5)去除结晶表面水分
(6)工艺简单、操作简单;纯度较低

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中有二氧化碳生成,因此溶液呈酸性。容易含有二氧化碳,而过氧化钙能与酸反应,因此将溶液煮沸的作用是除去溶液中溶解的CO2。
(4)根据原子守恒可知反应中还有氯化铵和水生成,则步骤③中反应的化学方程式为CaCl2+2NH3·H2O+H2O2=CaO2↓+2NH4Cl+2H2O;双氧水不稳定,受热易分解,因此该反应需要在冰浴下进行的原因是防止过氧化氢分解。
(5)过氧化钙在乙醇中的溶解度小,使用乙醇洗涤的目的是去除结晶表面的水分。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是原料来源丰富、操作简单;,产品的缺点是得到产品的纯度较低。
考点:考查物质制备实验设计
27.(15分)
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323K,NaClO2溶液浓度为5×103mol·L−1 。反应一段时间后溶液中离子浓度的分析结果如下表》
| 离子 | SO42− | SO32− | NO3− | NO2− | Cl− |
| c/(mol·L−1) | 8.35×10−4 | 6.87×10−6 | 1.5×10−4 | 1.2×10−5 | 3.4×10−3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。

①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2−+2SO32−===2SO42−+Cl−的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:

【解析】
试题分析:(1) NaClO2的化学名称为亚氯酸钠;
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为2OH-+3ClO2-+4NO=4NO3-+3Cl-+2H2O;;正反应是体积减小的,则增加压强,NO的转化率提高。
②根据反应的方程式2H2O+ClO2-+2SO2=2SO42+Cl-+4H+、2H2O+3ClO2-+4NO=4NO3-+3Cl-+4H+可知随着吸收反应的进行氢离子浓度增大,吸收剂溶液的pH逐渐降低。
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化。

(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①由于生成的硫酸钙微溶,降低硫酸根离子浓度,促使平衡向正反应方向进行,所以Ca(ClO)2效果好。
②已知:①SO2(g)+2OH−(aq)===SO32− (aq)+H2O(l)ΔH1
②ClO−(aq)+SO32−(aq)===SO42− (aq)+Cl− (aq)ΔH2
③CaSO4(s) ===Ca2+(aq)+SO42−(aq)ΔH3
则根据盖斯定律可知①+②-③即得到反应SO2(g)+Ca2+(aq)+ClO−(aq) +2OH−(aq) === CaSO4(s)+H2O(l) +Cl−(aq)的ΔH=△H1+△H2-△H3。
考点:考查氧化还原反应、盖斯定律、外界条件对反应速率和平衡状态的影响等
28.(14分)
以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124−形式存在于溶液中。“废渣2”中含有_______。

离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】(1)V2O5+2H+=2VO2++H2O;SiO2(2)0.5(3)Fe(OH)3、Al(OH)3
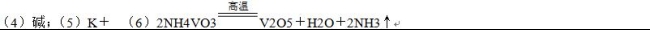
 (4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(4)根据方程式可知为了提高洗脱效率,反应应该向逆反应方向进行,因此淋洗液应该呈碱性。
(5)由于前面加入了氯酸钾和氢氧化钾,则“流出液”中阳离子最多的是钾离子。
(6)根据原子守恒可知偏钒酸铵(NH4VO3 “煅烧”生成七氧化二钒、氨气和水,发生反应的化学方程式为
![]()
考点:考查物质制备工艺流程图分析
36.[化学——选修2:化学与技术](15分)
聚合硫酸铁(PFS)是谁处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。

回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。


【解析】
试题分析:(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为Fe2O3·xH2O 。粉碎过筛的目的是控制铁屑的颗粒。
(2)由于不能引入杂质,则酸浸时最合适的酸是硫酸,铁锈与酸反应的离子方程式为Fe2O3·xH2O+6H+=2Fe3++3SO42-+(x+3)H2O。
(3)由于溶液中含有亚铁离子,则反应釜中加入氧化剂的作用是氧化Fe2+,由于不能引入杂质,则氧化剂中最合适的是绿色氧化剂双氧水。

考点:考查化学与技术模块分析,侧重于物质制备
37.[化学——选修3:物质结构与性质](15分)
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式______。
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga_______As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为__________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为______,Ga与As以___键键合。Ga和As的摩尔质量分别为MGa g·mol-1 和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______。

【答案】(1)1s22s22p63s23p63d104s24p3 (2) 大于、小于(3)三角锥形、sp3
(4)GaF3是离子晶体,GaCl3是分子晶体,离子晶体GaF3的熔沸点高;
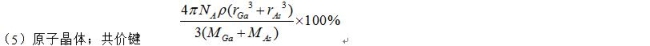

(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示,熔点很高,所以晶体的类型为原子晶体,其中Ga与As以共价键键合。根据晶胞晶胞可知晶胞中Ca和As的个数均是4个,所以晶胞的体积是

该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______,。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4-二苯基丁烷,理论上需要消耗氢气_______mol。
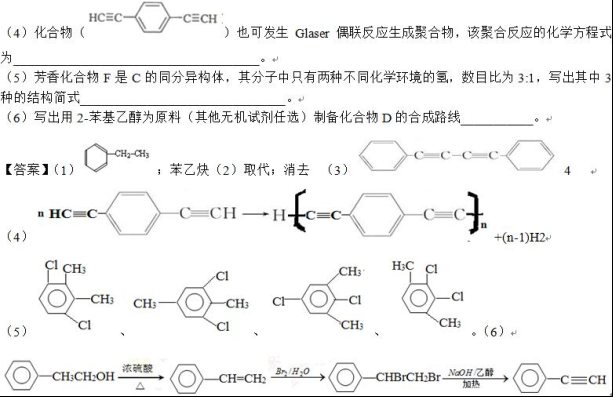


 考点:考查有机物推断与合成
考点:考查有机物推断与合成
